Die Suche nach dem richtigen Unternehmen für die Arzneimittelkennzeichnung wirkt sich auf alles aus, von den Fristen für die behördliche Zulassung bis hin zu den Ergebnissen der Patientensicherheit. Im Gegensatz zu Anbietern von Standarddruckereien müssen sich Partner für pharmazeutische Etikettierung mit komplexen regulatorischen Anforderungen auseinandersetzen, validierte Prozesse aufrechterhalten und innerhalb enger Fristen eine Null-Fehler-Qualität liefern. Wenn Sie falsch wählen, werden Sie mit verzögerten Produkteinführungen, Compliance-Risiken oder Problemen mit der Patientensicherheit aufgrund von Etikettierungsfehlern konfrontiert sein.
Einführung in die Arzneimittelkennzeichnung
Pharmazeutische Etiketten sind das entscheidende Bindeglied zwischen Ihrem Medikament und der Patientensicherheit. Jede Dosierungsanweisung, jede Sicherheitswarnung und jedes behördliche Detail ist wichtig, da ein Fehler Rückrufe, behördliche Maßnahmen oder Schäden für den Patienten auslösen kann.
Die pharmazeutische Kennzeichnungsbranche umfasst Unternehmen mit unterschiedlichem pharmazeutischem Fachwissen und regulatorischem Wissen. Der Schlüssel liegt darin, Partner zu finden, die die Anforderungen an die Arzneimittelherstellung wirklich verstehen und sich problemlos in Ihre bestehenden Entwicklungsabläufe integrieren lassen. Wählen Sie bei der Bewertung von Partnern Unternehmen mit nachgewiesener pharmazeutischer Erfahrung gegenüber Unternehmen aus, die Pharmaarbeiten als Zusatzleistung behandeln. Führende Unternehmen für pharmazeutische Etikettierung arbeiten nach cGMP-Standards, führen FDA-Registrierungen durch und beschäftigen Mitarbeiter, die eher in pharmazeutischen Qualitätssystemen als in grundlegenden Druckverfahren geschult sind.
Grundlegendes zu den Anforderungen an das Etikett
Ihr Etikettierungspartner muss die pharmazeutischen Vorschriften in- und auswendig kennen, insbesondere wenn es um FDA-konforme Designs geht, die durch Systeme wie Kallik und Veeva. Suchen Sie nach Partnern, die direkt in diese pharmazeutischen Designplattformen integriert sind, damit Ihr gesetzeskonformes Kunstwerk genau so gedruckt wird, wie es entworfen wurde. Die FDA-Vorschriften verlangen bestimmte Schriftgrößen für wichtige Informationen, eine präzise Platzierung von Warnhinweisen und die exakte Wiedergabe von genehmigten behördlichen Texten. Die EU-Richtlinien fügen mehrsprachige Anforderungen und regionsspezifische Sicherheitshinweise hinzu.
Verschiedene Produkte unterliegen unterschiedlichen Regeln. Verschreibungspflichtige Medikamente unterliegen strengeren Standards als rezeptfreie Produkte, und kontrollierte Substanzen erfordern Sicherheitsmerkmale und Nachverfolgungsmöglichkeiten. Die besten Partner zeigen Ihnen anhand konkreter Beispiele, wie sie mit unterschiedlichen Anforderungen in den verschiedenen Produktkategorien umgegangen sind.
Suchen Sie nach Partnern, die mit speziellen Ressourcen über regulatorische Änderungen auf dem Laufenden bleiben. Sie verfügen über Systeme zur Aktualisierung von Prozessen, wenn sich die Vorschriften ändern, und Dokumentationspakete, die Ihre behördlichen Unterlagen unterstützen. Unternehmen ohne diese regulatorische Grundlage gehen häufig Risiken ein, die Produkteinführungen aufgrund von Compliance-Lücken zum Scheitern bringen oder die Patientensicherheit durch eine nicht vorschriftsmäßige Kennzeichnung gefährden können.

Auswahl der richtigen Etikettenmaterialien für pharmazeutische Produkte
Materialkompetenz wirkt sich direkt auf den Produkterfolg aus, weshalb das Substratwissen Ihres Partners von entscheidender Bedeutung ist. Erfahrene Unternehmen im Bereich der pharmazeutischen Etikettierung wissen, welche Materialien unter unterschiedlichen Lagerbedingungen funktionieren, und können aufgrund der schwierigen Umweltherausforderungen, denen pharmazeutische Produkte während ihres gesamten Lebenszyklus ausgesetzt sind, die richtigen für Ihre Produkte empfehlen.
Gekühlte Biologika erfordern Materialien, die auch bei kühler Lagerung haften und lesbar sind, während Tabletten bei Umgebungstemperatur Substrate benötigen, die sich unter Lagerbedingungen nicht zersetzen. Pharmazeutische Anwendungen erfordern oft spezielle Materialien, die über die grundlegende Haltbarkeit hinausgehen. Manipulationssichere Substrate weisen deutliche Anzeichen von Interferenzen auf und schützen die Patienten vor schädlichen Produkten. Temperaturempfindliche Materialien verändern ihr Aussehen, wenn sie Hitze ausgesetzt werden. Dadurch wird visuell bestätigt, dass die Anforderungen an die Kühlkette eingehalten wurden.
Unternehmen, die sich auf die Kennzeichnung pharmazeutischer Produkte spezialisiert haben, stützen ihre Materialempfehlungen mit tatsächlichen Testdaten, darunter Studien zur beschleunigten Alterung, Haftungstests und Überprüfung der Chemikalienbeständigkeit. Sie sollten diese Dokumentation bereitstellen, ohne dass Sie danach fragen müssen. Wenn sie Ihnen diese umfassenden Testdaten nicht zeigen können, suchen Sie weiter.
Sicherheitsmerkmale kennzeichnen
Maßnahmen zur Fälschungsbekämpfung haben zunehmend an Bedeutung gewonnen, da Arzneimittelfälschungen weltweit sowohl die Markenintegrität als auch die Patientensicherheit gefährden. Ihr Partner für die Etikettierung benötigt echtes Fachwissen im Bereich Sicherheitstechnologien und keine oberflächliche Vertrautheit mit grundlegenden Authentifizierungsmethoden.
Moderne Sicherheitslösungen bestehen aus mehreren Schichten, wobei holographische Elemente und Sicherheitstinten für eine visuelle Authentifizierung sorgen, die Patienten und Gesundheitsdienstleister überprüfen können, während Mikrodruck und spezielle Substrate Fälscher vor technische Hindernisse stellen. Sie sollten verstehen, wie diese Technologien als integriertes Sicherheitssystem zusammenarbeiten. RFID- und Smart-Label-Funktionen ermöglichen die Nachverfolgung der Lieferkette in Echtzeit und unterstützen gleichzeitig die Serialisierungsanforderungen. Daher benötigen sie Fachwissen sowohl in Bezug auf physische Druckprozesse als auch auf Datenmanagementsysteme. Fragen Sie potenzielle Partner nach ihren Erfahrungen mit der Verknüpfung dieser Technologien mit bestehenden Tracking-Systemen und fordern Sie Fallstudien an, die die tatsächlichen Implementierungsergebnisse zeigen. Manipulationssichere Lösungen erfordern eine sorgfältige Substratauswahl und Anwendungstechniken, bei denen die Effektivität der Sicherheit mit der praktischen Benutzerfreundlichkeit für legitime Benutzer in Einklang gebracht wird.
Einhaltung der Arzneimittelkennzeichnung und Änderungskontrolle
Steuerung ändern Die Fähigkeiten unterscheiden professionelle Pharmaetikettierungsunternehmen von kommerziellen Druckereien, die sich mit regulierten Umgebungen nicht auskennen. Die pharmazeutische Herstellung unterliegt strengen Anforderungen an die Änderungskontrolle, die Ihr Etikettierungspartner verstehen und vollständig unterstützen muss. Prüfen Sie bei der Bewertung potenzieller Partner deren Change-Management-Systeme, um zu sehen, wie sie mit den Dokumentationsanforderungen umgehen und gleichzeitig die ordnungsgemäßen Genehmigungsabläufe einhalten. Professionelle Partner stellen die Validierungsprotokolle und Folgenabschätzungen zur Verfügung, mit denen Sie die Vorschriften einhalten und gleichzeitig die Einreichung behördlicher Auflagen vereinfachen.
Finden Sie Unternehmen, die behördliche Anträge aktiv durch umfassende technische Unterlagen und Expertengutachten unterstützen, wenn Aufsichtsbehörden zusätzliche Informationen benötigen. Partner mit Fachwissen in regulatorischen Angelegenheiten helfen Ihnen dabei, komplexe Genehmigungsverfahren zu bewältigen und Compliance-Fehler zu vermeiden, die Ihre Markteinführung verzögern. Das Änderungskontrollsystem Ihres Partners sollte sich nahtlos in Ihre pharmazeutischen Qualitätssysteme integrieren lassen, ohne zusätzlichen Aufwand zu verursachen. Zumindest sollten beide Systeme miteinander kommunizieren oder Funktionen für die Zusammenarbeit bieten, die Ihren Arbeitsablauf optimieren und gleichzeitig die Dokumentation bereitstellen, mit der die Aufsichtsbehörden zufrieden sind. Mit dem richtigen Partner fühlt sich die Steuerung von Änderungen natürlich und nicht als lästig an.
Spezialisierte Kennzeichnungslösungen für klinische Studien
Die Kennzeichnung klinischer Studien erfordert spezielle Funktionen, die mit der Standardkennzeichnung von Arzneimitteln nicht abgedeckt werden können. Wenn Ihre Pipeline klinische Produkte umfasst, stellen Sie sicher, dass potenzielle Partner über validierte Verfahren für diese komplexen Anforderungen verfügen. Durch Verblindungstechniken wird die Integrität der Studie gewährleistet, indem Behandlungsaufträge vor Teilnehmern und Prüfern verborgen bleiben und gleichzeitig die Randomisierungsprotokolle durch spezielle Druckverfahren und Qualitätskontrollen eingehalten werden. Fragen Sie potenzielle Partner nach konkreten Beispielen für von ihnen implementierte Verblindungslösungen zusammen mit der Validierungsdokumentation, die diese Prozesse unterstützt.
Die Unterstützung der Randomisierung und die Koordination von Studien an mehreren Standorten erfordern Funktionen zum Drucken variabler Daten, die eindeutige Identifikatoren zuweisen und gleichzeitig die Studienprotokolle an allen Standorten weltweit einhalten. Dies erfordert solide Datenmanagementsysteme und Qualitätskontrollen, die die Vertraulichkeit der Patienten schützen und gleichzeitig die von den Aufsichtsbehörden erwarteten Prüfprotokolle aufrechterhalten. Stellen Sie sicher, dass Ihr Partner vertrauliche klinische Daten ohne Risiko verwalten kann — Vertraulichkeit sollte sowohl in seinen Systemen als auch in seinen Arbeitsabläufen verankert sein.
Erweiterte Funktionen für pharmazeutische Etiketten
Etiketten mit erweitertem Inhalt und Technologien zum Abziehen und Wiederverschließen lösen Platzprobleme und bieten gleichzeitig umfassende Patienteninformationen. Daher sind sie besonders wertvoll, wenn Ihre Produkte umfangreiche Sicherheitsinformationen oder Materialien zur Patientenaufklärung benötigen. Smart-Label-Funktionen wie QR-Codes gewinnen zunehmend an Bedeutung, da die elektronische Etikettierung zunehmend an Bedeutung gewinnt, insbesondere in der EU und zunehmend in den USA. Diese QR-Codes sind in der Regel mit elektronischen Versionen von Etiketten verknüpft, sodass Hersteller umfassende Produktinformationen bereitstellen und gleichzeitig die Platzbeschränkungen auf physischen Verpackungen einhalten können. Nahfeldkommunikation (NFC) und Augmented Reality können die Patientenaufklärung verbessern und gleichzeitig die Einhaltung gesetzlicher Vorschriften gewährleisten.
Der Schlüssel liegt darin, sicherzustellen, dass sie sich mit bestehenden Patientenunterstützungsprogrammen verbinden, anstatt neue Ebenen hinzuzufügen oder getrennte Arbeitsabläufe zu erstellen. Fragen Sie potenzielle Partner nach ihren Erfahrungen mit der Implementierung erweiterter Funktionen und fordern Sie Leistungsdaten an, aus denen hervorgeht, dass sie während der gesamten Lebensdauer Ihres Produkts zuverlässig funktionieren. Erweiterte Funktionen müssen sorgfältig geprüft werden, um eine gleichbleibende Leistung unter realen Bedingungen sicherzustellen. Daher ist Innovationsfähigkeit bei der Bewertung langfristiger Partnerschaften wichtig. Halten Sie Ausschau nach Unternehmen, die in neue Technologien investieren und bei der Weiterentwicklung der Arzneimittelkennzeichnung eine Vorreiterrolle übernehmen, und nicht nach Unternehmen, die einfach den Branchentrends folgen.
Pharmazeutische Verpackungstypen und Etikettenanwendungen
Ihr Partner sollte Fachwissen über die für Ihr Produktportfolio relevanten Verpackungsformate nachweisen, da jeder Verpackungstyp einzigartige Herausforderungen bei der Etikettierung mit sich bringt.
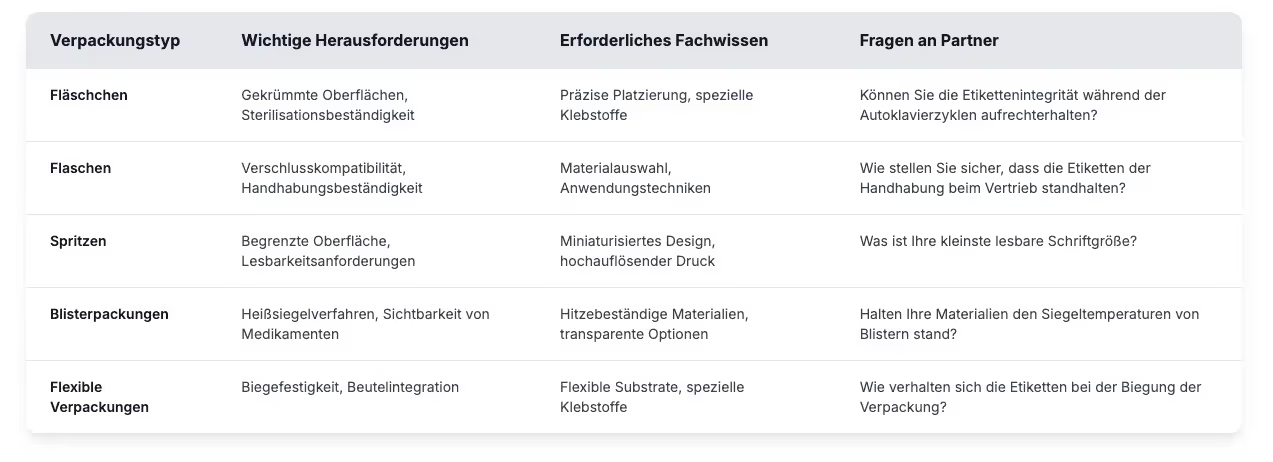
Bewerten Sie die Erfahrungen potenzieller Partner mit Ihren spezifischen Verpackungstypen, indem Sie Beispiele für ähnliche Anwendungen und Leistungsdaten anfordern, die erfolgreiche Implementierungen unter realen Bedingungen belegen. Spezialisierte Pharmapartner wissen, wie Sie Substrate, Klebstoffe und Haltbarkeitsanforderungen an Ihr Produkt anpassen können.
Ökologische Nachhaltigkeit bei der Arzneimittelkennzeichnung
Die Nachhaltigkeitskompetenzen verlagern sich von netten Unternehmensmerkmalen hin zu regulatorischen Erwartungen, die sich auf die Produktzulassung und den Marktzugang in vielen Märkten auswirken können. Spezialisten für pharmazeutische Kennzeichnungen investieren in umweltfreundliche Lösungen, die Leistungsstandards einhalten und gleichzeitig Ihre Umweltverpflichtungen erfüllen. Wiederverwertbare Substrate und biologisch abbaubare Klebstoffe können heute mit der Leistung herkömmlicher Materialien mithalten, aber die Auswahl der richtigen Materialien setzt ein klares Verständnis sowohl der Umweltauswirkungen als auch der pharmazeutischen Anforderungen voraus. Ihr Etikettierungspartner sollte wissen, wie sich diese Materialien unter Ihren Lagerbedingungen verhalten, und Lebenszyklusdaten bereitstellen, die sowohl die Nachhaltigkeitsberichterstattung als auch die Einhaltung gesetzlicher Vorschriften unterstützen.
Die Etikettenoptimierung reduziert die Umweltbelastung durch effiziente Layouts, die die Substratnutzung maximieren, und multifunktionale Designs, die Sekundärverpackungskomponenten eliminieren und gleichzeitig die von den Aufsichtsbehörden geforderte Informationsdichte aufrechterhalten. Die besten Partner sprechen nicht nur über Nachhaltigkeit — sie beweisen dies mit echten Daten und Maßnahmen. Sie wissen, woher ihre Materialien stammen, und verfolgen den Energieverbrauch ihrer Produktion. Wenn Produkte das Ende ihrer Lebensdauer erreichen, haben sie Entsorgungspläne, die tatsächlich funktionieren. Überspringen Sie die Unternehmen, die allgemeine Umweltangaben ohne entsprechende Daten aufstellen. Suchen Sie nach Partnern, die ihren CO2-Fußabdruck nachweisen, nachweisen können, dass sie weniger Abfall verschwenden, und erklären können, wie sie sich weiter verbessern wollen.
Unternehmen, die sich auf die Kennzeichnung pharmazeutischer Produkte spezialisiert haben, bieten Daten zum CO2-Fußabdruck, Nachhaltigkeitszertifizierungen, Erfolge bei der Abfallreduzierung und Pläne zur kontinuierlichen Verbesserung, die Ihre Unternehmensziele unterstützen und gleichzeitig die Produktsicherheit und die Einhaltung gesetzlicher Vorschriften gewährleisten, die die Patientenversorgung erfordert.

Qualitätssicherung bei der Arzneimittelkennzeichnung
Die Fähigkeiten zur Qualitätssicherung unterscheiden Unternehmen, die pharmazeutische Etiketten drucken, von Unternehmen, die sich mit der pharmazeutischen Herstellung wirklich auskennen. Der Unterschied zeigt sich in ihrem Ansatz zur Fehlervermeidung, in ihrem ausgeklügelten Inspektionssystem und in der Frage, ob ihre Qualitätsdokumentation tatsächlich Ihre behördlichen Anforderungen erfüllt, anstatt zusätzlichen Aufwand zu verursachen. Automatisierte Überprüfungstechnologien haben sich zur bevorzugten Methode für die Qualitätskontrolle von Arzneimittelkennzeichnungen entwickelt. Dabei werden Text, Grafiken, Barcodes und Rechtschreibung mit genehmigten Inhalten verglichen — mit einer Präzision, die eine manuelle Überprüfung nicht erreichen kann.
Die cGMP-Konformität bei der Etikettenherstellung bedeutet, Umweltkontrollen für gleichbleibende Bedingungen aufrechtzuerhalten, Geräte für reproduzierbare Ergebnisse zu qualifizieren und das Personal in pharmazeutischen Herstellungsprinzipien zu schulen, die über grundlegende Druckkenntnisse hinausgehen. Stellen Sie bei der Bewertung potenzieller Partner sicher, dass sie die ordnungsgemäßen Registrierungen und Qualitätszertifizierungen in den Einrichtungen einhalten, und beobachten Sie, wie sich diese Anforderungen im Rahmen ihrer Qualitätskontrollprozesse — eingehende Materialinspektion, prozessbegleitende Überwachung und Überprüfung des fertigen Produkts — auf den täglichen Betrieb auswirken. Die Dokumentation dieser Prozesse sollte sich problemlos in Ihre pharmazeutischen Qualitätssysteme integrieren lassen.
Zusammenarbeit mit Unternehmen für pharmazeutische Etikettierung
Finanzielle Stabilität und Geschäftskontinuität sind wichtig, da Verzögerungen bei der Etikettierung Ihren gesamten Produktionsbetrieb zum Erliegen bringen können. Informieren Sie sich über die finanzielle Situation potenzieller Partner, die Notfallpläne für Einrichtungen und wie sie mit Notfällen umgehen, die Ihre Lieferkette stören könnten.
Zu den wichtigsten Fragen für potenzielle Lieferanten gehören:
- Behalten Sie die FDA-Registrierung und die aktuelle cGMP-Konformitätszertifizierung bei?
- Über welche Qualitätszertifizierungen verfügen Sie (ISO 9001, pharmazeutische Zertifizierungen usw.)?
- Gibt es Kundenreferenzen für ähnliche pharmazeutische Anwendungen?
- Erzählen Sie uns von Ihren Produktionskapazitäten und Reaktionszeiten für Notfälle.
- Wie lässt sich Ihr Änderungskontrollsystem in pharmazeutische Qualitätssysteme integrieren?
- Wie bleiben Sie über regulatorische Änderungen auf dem Laufenden und welche Validierungsdokumente stellen Sie für Einreichungen zur Verfügung?
- Können Sie die Produktion skalieren, um unsere Volumenanforderungen zu erfüllen?
- Unterstützen Sie die Kennzeichnung für unsere Zielmärkte weltweit?
Diskutieren Sie über ihre Materialfähigkeiten, Drucktechnologien und darüber, wie ihre Qualitätssysteme mit Ihren bestehenden Prozessen zusammenarbeiten und nicht gegen sie.
Starke Partnerschaften entstehen nicht zufällig — sie erfordern echte Arbeit von beiden Seiten. Sie benötigen regelmäßige Check-ins, Leistungsverfolgung und ehrliche Kommunikation, damit alles funktioniert. Die besten Partner kümmern sich tatsächlich um Ihren Erfolg und nicht nur darum, Ihre Schecks einzulösen. Wenn Sie Vertragsdetails ausarbeiten, sollten Sie sich darüber im Klaren sein, wie Qualität aussieht, wer welche regulatorischen Aufgaben wahrnimmt und wie Sie die Leistung messen werden. Bauen Sie Spielraum für Veränderungen ein — ganz gleich, ob das bedeutet, sich an neue Vorschriften anzupassen, auf Notfälle zu reagieren oder entsprechend dem Wachstum Ihres Unternehmens zu skalieren.
Die Zukunft der Arzneimittelkennzeichnung
Die Anforderungen an die Serialisierung nehmen weltweit weiter zu, da immer mehr Länder Track-and-Trace-Vorschriften einführen, weshalb diese Funktionen heute für Partner im Bereich der pharmazeutischen Etikettierung unverzichtbar sind. KI-gestützte Inspektionstools gestalten die Etikettierungsabläufe mit automatisierten Qualitätsprüfungen und Fehlererkennung in Echtzeit bereits um. Große Pharmaunternehmen entwickeln Roadmaps für die Automatisierung von Inhalten und Etikettierung, bei denen KI-Agenten zur Erledigung wichtiger Aufgaben eingesetzt werden. Dabei werden manuelle Prozesse auf intelligente Automatisierung und integrierte Qualitätsprüfungen umgestellt. Die Einführung von E-Labeling wird sich beschleunigen, da sich die Aufsichtsbehörden mit digitalen Etiketten immer besser auskennen. Die EU ist führend, während die USA mit ihren eigenen digitalen Anforderungen Schritt für Schritt nachziehen. KI wird nicht nur Fehler erkennen, sondern auch Inhalte erstellen, die Einhaltung gesetzlicher Vorschriften automatisch überprüfen und Arbeitsabläufe ohne menschliches Zutun verwalten. Partner sollten nachweisen, dass sie diese Veränderungen in der Branche verstehen und konkrete Pläne für die Anpassung an KI-gestützte Anforderungen haben, anstatt vage Versprechen zu geben, mit der Technologie Schritt zu halten.
Fallstudien: Erfolgreiche pharmazeutische Kennzeichnungslösungen
Zwei Pharmaunternehmen standen vor unterschiedlichen Herausforderungen bei der Etikettierungsqualität, fanden jedoch mithilfe automatisierter Inspektionstechnologie ähnliche Lösungen.
Fallstudie 1: iNova Pharmaceuticals — Fehler vermeiden und Markteinführungen beschleunigen
iNova Pharmaceuticals ist in über 20 Ländern tätig und bietet Produkte an, die von der Gewichtskontrolle bis hin zur Dermatologie reichen. Sie mussten einen Grafikprozess schaffen, der in allen drei Regionen einheitlich funktionierte, ohne sich auf externe Studios verlassen zu müssen, über die sie wenig Kontrolle hatten. Durch die Einbindung von GlobalVision konnten sie wieder die Verantwortung für ihre Arbeitsabläufe im Bereich der Grafikverwaltung übernehmen und die Genauigkeit ihrer Dateien aus erster Hand überprüfen. Das Ergebnis? Schnellere, qualitativ hochwertigere Überarbeitungen und schnellere Markteinführung neuer Produkte. Erfahren Sie, wie iNova seinen Qualitätsprozess verändert hat
Fallstudie 2: Johnson & Johnson's Ethicon — Skalierung von Qualitätsprüfungen weltweit
Die weltweite Etikettierungsabteilung von Johnson & Johnson musste mühsame manuelle Vergleiche zwischen allen Dateirevisionen durchführen. Die GlobalVision-Software vereinfachte ihr Korrekturlesen, indem beabsichtigte Änderungen verworfen und kritische oder unbeabsichtigte Änderungen zur Untersuchung gekennzeichnet wurden. Seit der Implementierung haben sie viel Zeit durch schnelle Dateiinspektionen gespart und gleichzeitig die Gewissheit gewonnen, dass ihre neueste Arbeitsversion fehlerfrei ist. Das Ergebnis: durchweg präzise Verpackung und Etikettierung, die das Risiko von Inhalts- und Grafikfehlern ausschließt. Lesen Sie die vollständige Fallstudie von Johnson & Johnson.
Diese Beispiele zeigen, dass unabhängig davon, ob Sie Prozesse intern einführen oder bestehende Abläufe weltweit skalieren, die Auswahl von Partnern mit fortschrittlichen Inspektionsfunktionen zu messbaren Verbesserungen sowohl der Geschwindigkeit als auch der Genauigkeit führt.
Überlegungen zum technischen Support und zum Kundenservice
Technischer Support ist wichtig, da Probleme mit der Etikettierung Ihren gesamten Fertigungsbetrieb zum Erliegen bringen können. Sie müssen wissen, dass Ihr Partner tatsächlich helfen kann, wenn etwas schief geht, und nicht nur in seinen Marketingmaterialien einen guten Service versprechen. Wenn Sie sich die Unterstützungsmöglichkeiten der Pharmapartner ansehen, sollten Sie die folgenden wesentlichen Faktoren berücksichtigen:
Struktur des technischen Supports:
- Kundenbetreuer, die die pharmazeutische Arbeit tatsächlich verstehen
- Technische Experten, die Sie bei Problemen erreichen können
- Reaktionszeiten, die für Ihren Betrieb geeignet sind
- Klare Wege zur Eskalation dringender Probleme
Produktionskapazitäten für Notfälle:
- Backup-Pläne, wenn Lieferketten zusammenbrechen
- Zusätzliche Produktionskapazität für kritische Situationen
- Zugriff auf Backup-Einrichtungen, damit Sie nicht heruntergefahren werden
- Eilauftragsabwicklung und enges Terminmanagement
Schulungs- und Weiterbildungsdienste:
- Ihr Team schulen und sich mit neuen Systemen vertraut machen
- Alle auf dem Laufenden halten, wenn sich die Vorschriften ändern
- Zeigen Sie Ihrem Team neue Tools, die ihnen die Arbeit erleichtern könnten
- Stellen Sie Ihrem Team Ressourcen zur Verfügung, auf die es zurückblicken kann, wenn es Hilfe benötigt
Das richtige Unternehmen für pharmazeutische Etikettierung wird zu einem strategischen Partner in Ihrem Qualitätssicherungsprogramm, das Ihr regulatorisches Umfeld versteht und gleichzeitig das technische Fachwissen zur Verfügung stellt, das erforderlich ist, um die Einhaltung der Anforderungen sicherzustellen.
Sind Sie bereit, KI-gestützte Inspektionstechnologie in Aktion zu sehen? Verify von GlobalVision fängt Etikettierungsfehler auf, bevor sie zu kostspieligen Rückrufen werden.



