Introduction à l'emballage des dispositifs médicaux
L'emballage des dispositifs médicaux ne doit jamais être une question secondaire. C'est votre première ligne de défense contre les cauchemars réglementaires, les défaillances de produits et les rappels qui détruisent votre réputation du jour au lendemain.
Il protège la sécurité des patients d'une manière qui va bien au-delà de la propreté des produits pendant l'expédition. Lorsque les professionnels de santé ouvrent votre colis, ils doivent avoir la certitude que tout ce qu'il contient répond aux normes de sécurité les plus strictes. Le secteur de la santé tolère très peu les défauts d'emballage, car les enjeux sont trop importants.
Le paysage réglementaire devenant de plus en plus complexe, les entreprises qui comprennent ces exigences et construisent des systèmes d'emballage solides obtiennent un avantage concurrentiel significatif. Les décisions prises à l'avance en matière d'emballage peuvent être déterminantes ou défavorables à la réussite réglementaire, et les entreprises qui investissent dans les bons systèmes dès le départ évitent des problèmes de conformité coûteux en fin de compte.
Exigences relatives à l'emballage des dispositifs médicaux essentiels
Les fabricants de dispositifs médicaux qui essaient de comprendre exigences en matière d'emballage seuls, ils sont souvent confrontés à des défis inattendus plus tard dans leur développement. Les exigences en matière de documentation peuvent à elles seules submerger les équipes qui n'ont pas planifié à l'avance.
Les besoins en matière d'emballage varient selon la classe d'appareil, la complexité et les délais étant ajustés en conséquence :
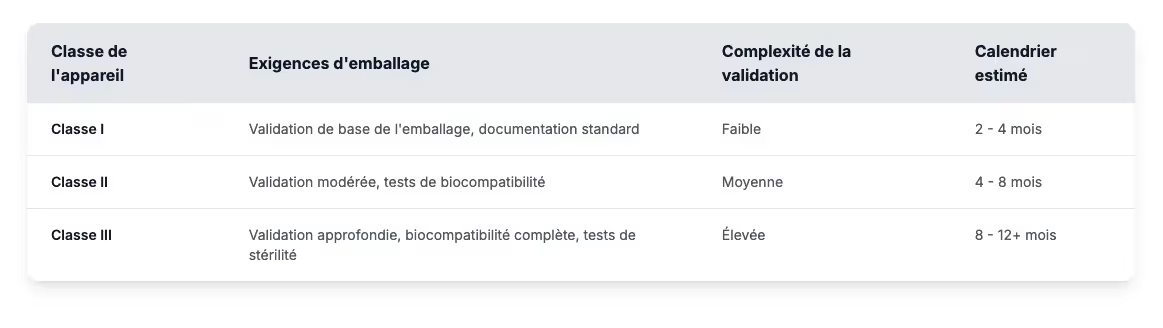
Les normes réglementaires clés telles que la norme ISO 11607 pour les emballages et les exigences régionales telles que la norme FDA 21 CFR Part 820 ou la conformité au MDR de l'UE orienteront votre approche de validation et détermineront les protocoles de test à suivre.
La sélection des matériaux contrôle tout le reste de votre système d'emballage. Si vous sélectionnez des matériaux qui ne sont pas compatibles avec votre procédé de stérilisation, vous découvrirez lors des tests de validation que les modifications deviendront beaucoup plus coûteuses. Pour les dispositifs médicaux stériles, vos matériaux doivent résister à la méthode de stérilisation choisie, qu'il s'agisse de rayons gamma, d'oxyde d'éthylène ou de vapeur, sans se dégrader ni libérer de composés nocifs.
La qualification de l'installation, la qualification opérationnelle et la qualification des performances (IQ, OQ, PQ) sont bien plus que des cases à cocher, elles prouvent que vos processus d'emballage fonctionnent réellement lorsque les régulateurs viennent vous poser des questions. Une validation précipitée entraîne souvent des retouches coûteuses lorsque les auditeurs découvrent des lacunes.
L'approche intelligente implique des preuves documentées à chaque étape. Vous devez prouver que votre équipement fonctionne correctement, que vos processus produisent des résultats cohérents et que votre système d'emballage préserve l'intégrité des produits sur plusieurs sites et dans des conditions réelles.
Normes d'étiquetage des dispositifs médicaux
Les exigences en matière d'étiquetage des emballages ont une valeur légale que les régulateurs prennent au sérieux lors des inspections. Les systèmes UDI créent une responsabilité de bout en bout, de la fabrication à la surveillance après commercialisation.

Les règles d'étiquetage MDR de la FDA et de l'UE s'alignent rarement, ce qui crée des défis pour la distribution mondiale. Des systèmes clairs aident les équipes à rester en conformité dans toutes les régions. De nombreux fabricants desservant les marchés internationaux conçoivent des systèmes d'étiquetage flexibles qui répondent à différentes exigences réglementaires sans nécessiter des approches d'emballage complètement différentes pour chaque marché.
Systèmes de barrières stériles : la base de l'emballage médical
Les systèmes de barrières stériles représentent la décision la plus importante que vous devrez prendre en matière d'emballage de dispositifs médicaux. Ces systèmes garantissent que les dispositifs conservent leur stérilité pendant toute leur durée de conservation, ce qui a un impact direct sur la sécurité des patients et votre conformité réglementaire.
Vos barrières doivent respecter les normes de stérilité requises tout en permettant aux professionnels de santé d'accéder aux appareils en toute sécurité sans contamination. Cet équilibre entre protection et facilité d'utilisation est à l'origine de la plupart des décisions relatives à la conception des emballages médicaux.
L'emballage primaire constitue votre défense immédiate contre la contamination. La sélection des matériaux se concentre ici sur les propriétés de barrière, la compatibilité avec les procédés de stérilisation et les performances des matériaux après des mois de stockage. L'emballage secondaire fournit une protection supplémentaire pendant la distribution tout en préservant l'intégrité de vos barrières principales.
Le maintien de la stérilité tout au long du cycle de vie du produit nécessite de comprendre les conditions réelles. Les changements de température, les fluctuations d'humidité et les contraintes liées à la manipulation constituent autant de défis pour vos barrières lors du stockage et de la distribution.
Exigences relatives à l'intégrité des emballages et à la résistance des joints
Les tests d'intégrité des emballages aident les entreprises de dispositifs médicaux prospères à éviter des rappels coûteux et des problèmes réglementaires. L'inspection visuelle permet de détecter les problèmes évidents, mais les méthodes de test avancées détectent les défaillances subtiles, telles que les fuites de joints qui pourraient compromettre la stérilité au fil du temps. Les tests de pénétration des colorants, d'émission de bulles et de décomposition sous vide fournissent des mesures quantitatives de l'efficacité des joints et aident à identifier les modes de défaillance potentiels avant qu'ils n'atteignent les patients.
La résistance du joint dépend à la fois du matériau et des méthodes de stérilisation. Par exemple, les sachets thermoscellés ont des performances différentes des plateaux adhésifs après stérilisation. Savoir à quoi s'attendre vous aide à créer un emballage plus résilient en concevant des protocoles de test qui tiennent compte de l'impact de la stérilisation sur les performances du scellage pendant toute votre durée de conservation.
Les défaillances d'intégrité courantes sont généralement dues à des problèmes de contrôle des processus : contamination des surfaces d'étanchéité, réglages de température incorrects ou synchronisation irrégulière. La surveillance continue et le contrôle statistique des processus permettent d'éviter ces problèmes plus efficacement que les tests réactifs.
Sélection des matières premières pour l'emballage des dispositifs médicaux
La compatibilité des matériaux d'emballage va bien au-delà des tests de résistance chimique de base. Les dispositifs médicaux passent des mois en contact direct avec les matériaux, ce qui permet à des composés chimiques nocifs de migrer et de provoquer potentiellement des problèmes.
Les matériaux qui entrent en contact avec des appareils stériles doivent répondre à des normes de sécurité strictes. Lorsque les équipes planifient si tôt, elles évitent les surprises de dernière minute et avancent avec plus de confiance. Les papiers de qualité médicale permettent la stérilisation au gaz ; les films d'emballage souples offrent une résistance à la perforation ; les plateaux moulés protègent les instruments complexes. Commencez par les besoins de votre appareil, puis sélectionnez des matériaux dont la sécurité et les performances ont été prouvées.
La qualification des matériaux couvre plusieurs domaines de performance : la capacité des matériaux à résister à la stérilisation, leur vieillissement au fil du temps, la résistance de l'étanchéité et l'efficacité de la barrière. Les tests spécifiques dont vous avez besoin dépendent de votre candidature, mais attendez-vous à ce que le processus de qualification prenne plusieurs mois. Les fabricants expérimentés fixent leurs choix de matériaux à un stade précoce pour éviter les retards dans les délais.
Technologies avancées dans le domaine de l'emballage des dispositifs médicaux
L'innovation dans le domaine des emballages médicaux vise à résoudre des problèmes réels qui frustrent les fabricants depuis des années. Les films de formage conçus spécifiquement pour les produits médicaux durs éliminent les exigences en matière d'outillage personnalisé tout en offrant une protection supérieure des appareils. Les techniques de découpe améliorent la précision des matériaux et réduisent les déchets lors de la fabrication des emballages.
Les améliorations apportées à la technologie d'extrusion par moulage ont généralement permis d'améliorer la consistance des matériaux et de réduire les coûts pour les applications à volume élevé. Les constructions multicouches permettent aux fabricants de combiner différents polymères pour optimiser les propriétés de barrière, la résistance à la perforation et les caractéristiques d'étanchéité des matériaux individuels.
Les technologies d'emballage intelligent offrent de réelles capacités numériques aux emballages médicaux. Les étiquettes RFID permettent le suivi et l'authentification des stocks en temps réel, tandis que les indicateurs de température confirment le maintien de la chaîne du froid pendant l'expédition. Ces outils fournissent la transparence de la chaîne d'approvisionnement exigée par le marché sans compliquer vos processus existants.
Normes et pratiques : conformité à la norme ISO 11607
L'ISO 11607-1 jette les bases d'un emballage conforme des dispositifs grâce à des exigences spécifiques relatives aux matériaux et aux systèmes de barrières stériles. La compréhension précoce de ces exigences permet d'éviter des efforts de refonte coûteux à un stade ultérieur de votre processus de développement.
L'ISO 11607-2 se concentre sur les exigences de validation pour les processus de formage, de scellage et d'assemblage. Cette norme nécessite des preuves documentées pour démontrer la conformité et prouver que vos processus produisent systématiquement des emballages conformes aux spécifications. Votre approche de validation doit tenir compte des variations de votre procédé de fabrication et établir des limites de contrôle significatives.
Les stratégies de validation des emballages varient en fonction de la taille de votre équipe et de la complexité du produit. Quelle que soit la voie que vous choisissez, une documentation claire rend votre processus plus défendable et moins stressant. Les petits fabricants bénéficient souvent de partenariats avec des spécialistes de l'emballage qui apportent des protocoles de validation établis et une expertise réglementaire. Les grandes entreprises développent généralement des capacités internes mais peuvent toujours faire appel à des laboratoires d'essais externes pour des évaluations spécialisées. L'essentiel est de choisir une approche adaptée à vos ressources tout en vous assurant de répondre à toutes les exigences de validation de manière cohérente.
Considérations relatives à la distribution et au transport
Les normes ISTA fournissent des cadres pratiques pour les tests de performance des packages qui simulent les problèmes de distribution réels. Ces tests évaluent la façon dont vos systèmes réagissent aux vibrations, à la compression et aux forces d'impact pendant le transport.
Les tests de résistance pendant le transport révèlent des modes de défaillance que les tests de laboratoire omettent souvent, car les emballages qui passent les tests statiques peuvent échouer dans des conditions de charge dynamiques. Les tests de vibrations remettent particulièrement en question l'intégrité des joints et la protection des dispositifs médicaux délicats expédiés sur de longues distances.
La distribution dans le monde réel implique plusieurs manipulations, des changements de température et des vibrations. Vos tests doivent donc refléter ces conditions. La simulation précoce de ces scénarios réduit les surprises par la suite et contribue à protéger votre produit à chaque étape.
La durabilité dans l'emballage des dispositifs médicaux
Les considérations environnementales influencent de plus en plus les décisions relatives aux emballages médicaux, mais les exigences de stérilité limitent les choix de matériaux durables. Les polymères biosourcés dotés de certifications de qualité médicale et de conceptions d'emballage réduites offrent des alternatives prometteuses tout en maintenant les normes de performance et de sécurité requises.
Solutions d'emballage spécialisées pour les dispositifs médicaux
L'emballage des dispositifs médicaux nécessite souvent des solutions spécialisées allant au-delà des approches standard. L'emballage des seringues et des vaccins présente des défis uniques liés au maintien de la chaîne du froid et aux caractéristiques d'inviolabilité, nécessitant des systèmes qui protègent les composants en verre tout en permettant une inspection visuelle du contenu. Les combinaisons médicament-dispositif nécessitent des solutions à double chambre qui séparent les composants jusqu'à ce que quelqu'un les active. La technologie d'étanchéité doit empêcher toute contamination croisée tout en permettant un mélange correct au bon moment. Ces produits sont soumis à la fois à la réglementation pharmaceutique et aux réglementations relatives aux dispositifs, de sorte que les fabricants sont confrontés exigences de double conformité.
Les instruments chirurgicaux complexes peuvent nécessiter des plateaux moulés sur mesure qui fixent plusieurs composants dans des orientations spécifiques, tandis que les dispositifs médicaux électroniques ont besoin d'une protection antistatique et de barrières contre l'humidité au-delà des capacités d'emballage habituelles. Le fait de comprendre rapidement les exigences spécifiques de votre appareil vous permet de concevoir un emballage qui répond à toutes les protections nécessaires sans surdimensionner la solution.
Collaboration avec des experts en emballage de dispositifs médicaux
Le partenariat avec des experts en emballage vous donne accès à un savoir-faire en matière de réglementation et à des guides de validation éprouvés. Si les tests, la documentation ou l'évolution des normes vous ralentissent, le bon partenaire vous aide à servir vos clients plus rapidement, avec moins d'obstacles et en toute confiance. L'implication précoce dans le développement du produit permet d'éviter les décisions de conception qui posent des problèmes d'emballage ultérieurement, tout en identifiant souvent des opportunités de réduction des coûts et d'amélioration des performances. Leur implication redéfinit la façon dont l'emballage prend en charge l'ensemble de votre calendrier de lancement au lieu de simplement combler une lacune.
Des résultats concrets : la division Ethicon de Johnson & Johnson a renforcé son contrôle qualité mondial de l'étiquetage et a accéléré les délais de mise sur le marché grâce au technologie d'inspection appropriée.
Tendances futures en matière d'emballage des dispositifs médicaux
Les nouveaux matériaux de barrière, les outils d'inspection automatisés et les fonctionnalités d'authentification numérique placent la barre plus haut en matière d'emballages médicaux. Les régulateurs veulent davantage de données de surveillance après la mise sur le marché, ce qui signifie que les technologies d'emballage capables de suivre et de collecter des informations tout au long de la vie d'un produit gagnent en valeur.
Conclusion : garantir le succès de l'emballage des dispositifs médicaux
Un emballage efficace des dispositifs médicaux nécessite de trouver un équilibre entre sécurité et conformité avec des considérations pratiques en matière de coûts. Les équipes qui intègrent l'emballage au stade précoce du développement des produits sont mieux placées pour éviter les retards et les problèmes en aval.
Chaque projet d'emballage doit tenir compte de la complexité réelle des exigences réglementaires et de validation. Les entreprises qui pressent les délais ou qui sous-estiment les coûts voient souvent l'ensemble de leur projet en pâtir, bien au-delà du simple fait de ne pas avoir atteint leur date d'entrée sur le marché. Les fabricants sont confrontés à une pression constante en raison des nouveaux matériaux, de l'évolution des outils d'inspection et des mises à jour réglementaires. C'est beaucoup de choses à gérer par soi-même. C'est pourquoi les entreprises prospères établissent l'expertise et les partenariats appropriés. Les défis réglementaires auxquels sont confrontés certains fabricants constituent un avantage concurrentiel pour d'autres qui bénéficient d'un soutien approprié.




