L'essor de la technologie d'automatisation dans les affaires réglementaires

Resumé
Les technologies émergentes permettent aux sociétés pharmaceutiques d'accélérer le développement et la commercialisation de leurs produits plus rapidement que jamais. Ce rapport explique comment la technologie, en particulier l'automatisation et les technologies numériques, influent sur les affaires réglementaires de l'industrie pharmaceutique.
Les résultats ont conclu que l'automatisation et les technologies numériques aident les professionnels de la réglementation à réduire considérablement le temps de relecture et de révision, à minimiser les révisions et à commercialiser les produits plus rapidement.
En outre, les preuves montrent que ces technologies aident les professionnels de la réglementation à être plus rentables lors de l'expansion de la fabrication, ce qui améliore en fin de compte leurs résultats financiers.
Enfin, des preuves confirment que l'automatisation et les technologies numériques contribuent à garantir la mise en place d'avis de sécurité destinés aux consommateurs.
À l'avenir, l'étude prévoit avec une certitude raisonnable que l'automatisation et la technologie numérique continueront de se développer dans tous les départements de l'industrie pharmaceutique, tout en influençant de manière significative l'alignement futur des affaires réglementaires au niveau mondial.
Naviguer dans le paysage des affaires réglementaires
Chaque pays dispose d'une agence de réglementation chargée de s'assurer que les consommateurs achètent des produits de santé fiables et fiables. Les États-Unis Administration des aliments et des médicaments (FDA) détient un Bureau des affaires réglementaires (ORA) for réglementer les produits liés à la santé publique.1 De même au Canada, Health Canada module les produits grâce à leurs Direction des produits de santé et des aliments (HPFB). 2 Dans l'Union européenne, le Agence européenne des médicaments (EMA) est le fer de lance du cycle de vie des médicaments dans la région. 3 Grâce à la mise en place d'agences de réglementation, il est possible de réduire le nombre d'erreurs de médication, c'est-à-dire de cas d'utilisation inappropriée des médicaments.
Pourtant, les statistiques montrent une situation différente. Une statistique de la FDA de Harvard Health Publishing rapporte que l'agence a fait l'objet de plus de 14 000 rappels de médicaments au cours de la dernière décennie, soit une moyenne approximative de quatre rappels de médicaments par jour4.

Les entreprises s'appuient sur des professionnels des affaires réglementaires pour s'assurer que les produits sont conformes aux exigences législatives. Cependant, de grands volumes de produits pharmaceutiques sont continuellement expédiés sur le marché avec des erreurs, notamment un étiquetage posologique incorrect. Pour y remédier, les entreprises utilisent des technologies numériques et d'automatisation innovantes pour rationaliser les processus réglementaires dans les flux de travail qui nécessitent autrement de nombreuses inspections manuelles.
Ce rapport explique comment les professionnels des affaires réglementaires de l'industrie pharmaceutique utilisent ces technologies pour rester en conformité et protéger les consommateurs.
Méthodologie
Nos recherches ont porté sur des méthodes mixtes, étudiant des sujets spécialisés dans les affaires réglementaires.
Notre enquête a recueilli des données auprès de 28 professionnels des affaires réglementaires issus de différentes tailles d'entreprises. L'enquête a identifié des tendances concernant l'impact de l'automatisation et des technologies numériques sur les procédures de conformité et les indicateurs de réussite.
Demography
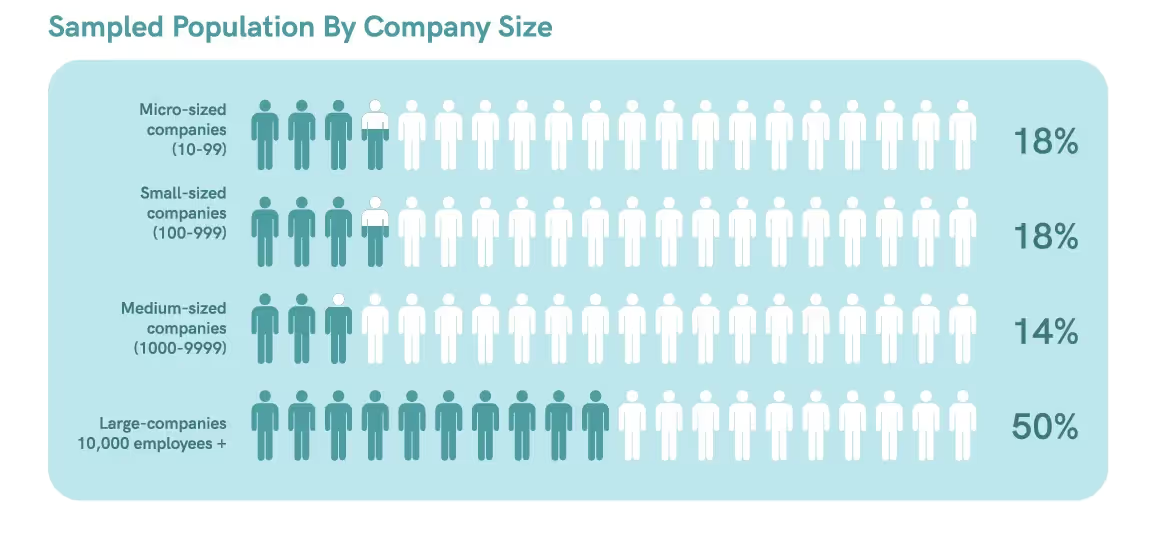

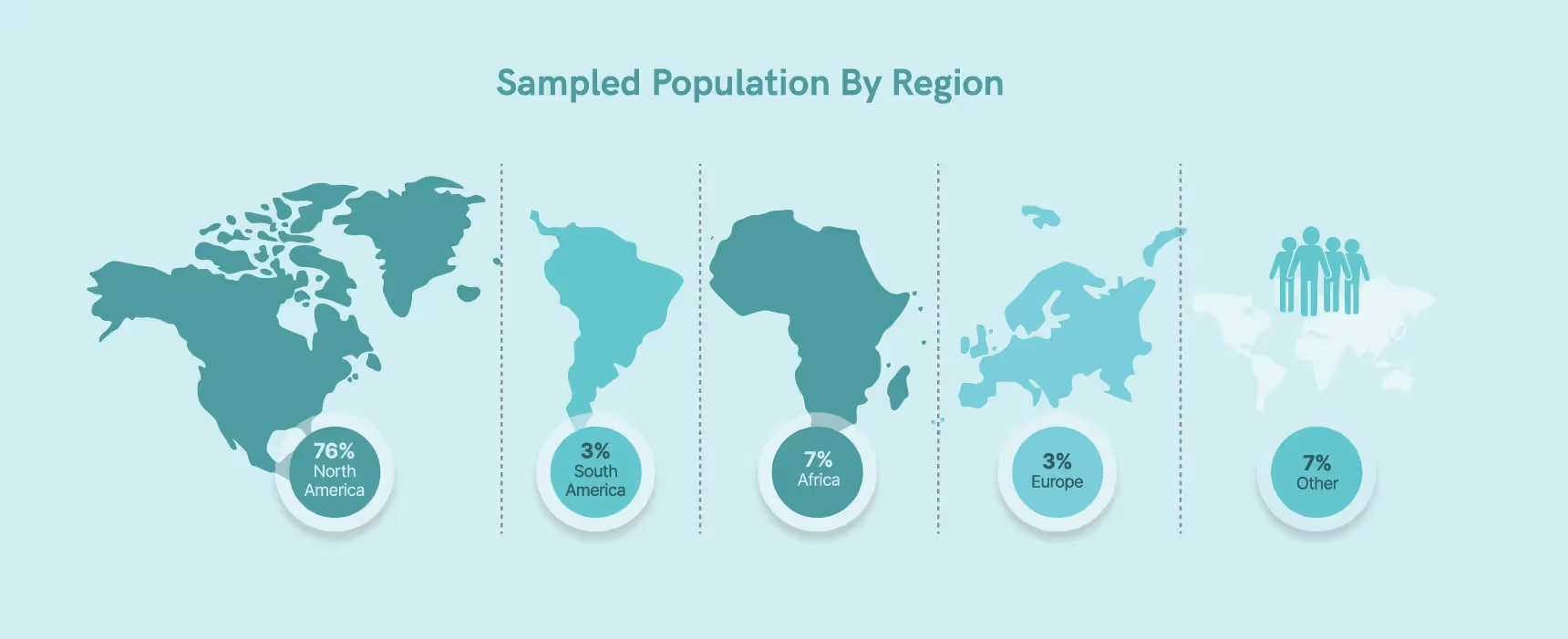
Geographical application field
Notre secteur se concentre principalement sur la région occidentale, 76 % de nos personnes interrogées résidant en Amérique du Nord (les autres personnes interrogées étaient les suivantes : 7 % en Afrique, 3 % en Europe, 3 % en Amérique du Sud, 7 % dans les autres régions).
De même, l'Amérique du Nord et l'Europe représentent environ 66 % du marché pharmaceutique mondial, selon un rapport de la RAPS (Regulatory Affairs Professionals Society) de 2021.5
En outre, nous avons mené une étude de marché externe à partir d'une bibliothèque soigneusement sélectionnée sur un groupe démographique similaire qui a un impact macroéconomique sur le secteur.
Comprendre l'industrie pharmaceutique
Avant d'approfondir les affaires réglementaires, il est indispensable de comprendre l'industrie pharmaceutique. Qui est responsable du développement, de la production et de la distribution de médicaments de santé, opérant dans un cadre réglementaire complexe.
Market Perspectives
Malgré ses complexités, l'industrie pharmaceutique mondiale continue de croître rapidement, les médicaments les plus performants sur le plan commercial pouvant chacun générer plus d'un milliard de dollars américains par an6.
Le marché des produits pharmaceutiques devrait atteindre un volume de marché de
1,16 milliard de dollars américains en 2023, avec un taux de croissance annuel composé (TCAC) d'environ 5,39 % pour atteindre 1,44 milliard de dollars américains d'ici 2027.
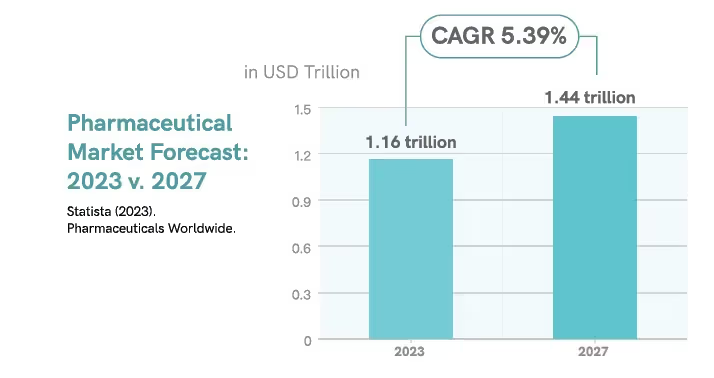
Bien que ces prévisions semblent prometteuses, les tendances pharmaceutiques actuelles suscitent certaines inquiétudes quant aux coûts variables du secteur et aux opportunités d'économies, telles que l'adaptation des utilisateurs aux avancées technologiques, les défis du marché du travail et l'inflation8.

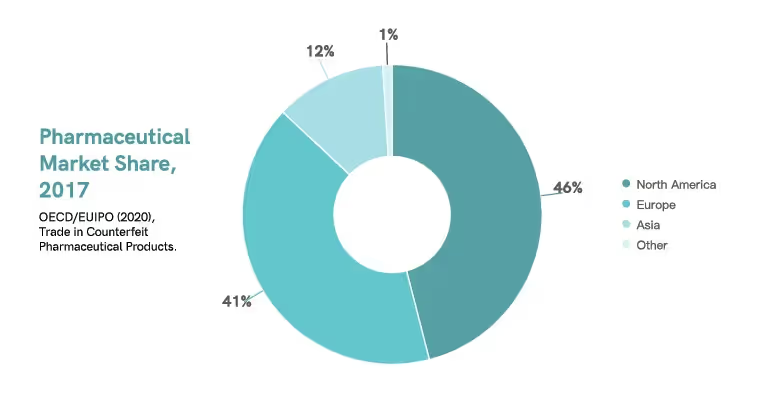
Selon une étude réalisée en 2017, l'Amérique du Nord a saturé environ 46 % du marché pharmaceutique mondial, suivie de l'Europe avec environ 41 % et de l'Asie avec environ 12 %.9 Actuellement, les États-Unis et l'Europe dominent le marché pharmaceutique mondial5.
Categories d'entreprises
L'industrie se caractérise par diverses entreprises spécialisées dans les soins de santé, les sciences de la vie et les pratiques biotechnologiques. Il s'agit notamment de :
- Pharmaceuticals Insurance Research
- Les sociétés pharmaceutiques génériques
- Organisations de développement et de fabrication sous contrat (CDMO)
- Biopharmaceuticals
Pharmaceuticals Insurance Research

Ces entreprises se concentrent sur la recherche et le développement (R&D) pour découvrir et développer de nouveaux produits pharmaceutiques et investissent massivement dans la recherche scientifique et les essais cliniques.
Les sociétés pharmaceutiques génériques

Ces sociétés produisent et commercialisent des versions génériques de médicaments de marque après l'expiration de la protection conférée par le brevet. Ils visent à proposer des alternatives plus abordables aux médicaments de marque.
Organisations de développement et de fabrication sous contrat (CDMO))

Ces sociétés proposent des services externalisés pour le développement, la formulation, la fabrication et le conditionnement de médicaments pour les sociétés pharmaceutiques.
Biopharmaceuticals

Ces sociétés se concentrent sur le développement de médicaments dérivés de sources biologiques, telles que des organismes vivants, des cellules, des protéines et des anticorps.
L'industrie continue d'évoluer avec l'émergence de modèles hybrides des sociétés susmentionnées. Par conséquent, ces types de sociétés ne s'excluent pas mutuellement.
Les parties prenantes de l'industrie pharmaceutique vont au-delà du consommateur final
Les sociétés pharmaceutiques ont la responsabilité de satisfaire trois principaux groupes de clients10 :
- Patients : En raison des contraintes réglementaires, les entreprises pharmaceutiques ont peu de possibilités d'interagir directement avec les patients.
- Personnel en contact direct avec les patients : Il s'agit notamment des médecins généralistes (GP),
des médecins spécialisés, des pharmaciens et des infirmières.
- Régulateurs : Tes organismes de réglementation comprennent la FDA et Santé Canada.
Theme principal : Le professionnel des affaires réglementaires
Le service des affaires réglementaires garantit la sécurité, l'efficacité et la qualité des produits pharmaceutiques.11 Sur plus de 98 000 professionnels de la réglementation dans le monde, 65 % sont spécialisés dans la surveillance des produits pharmaceutiques.5
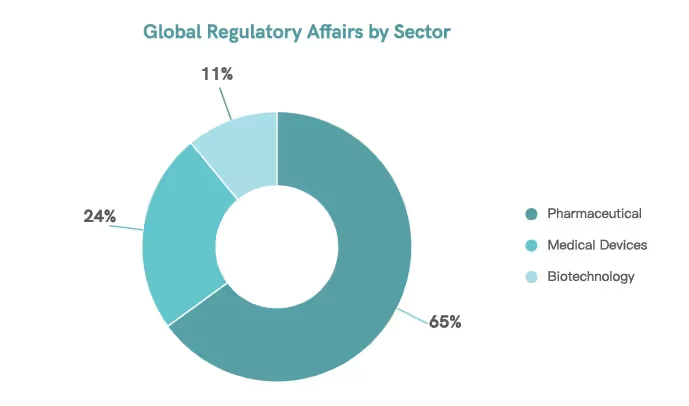
Les professionnels de la réglementation jouent un rôle essentiel pour relever les défis liés aux exigences réglementaires mondiales et s'assurer que les entreprises se conforment aux normes, devenant ainsi la pierre angulaire du développement et de la commercialisation des produits. Grâce à leur travail, les entreprises sont en mesure de protéger leurs produits et d'améliorer la santé publique11.
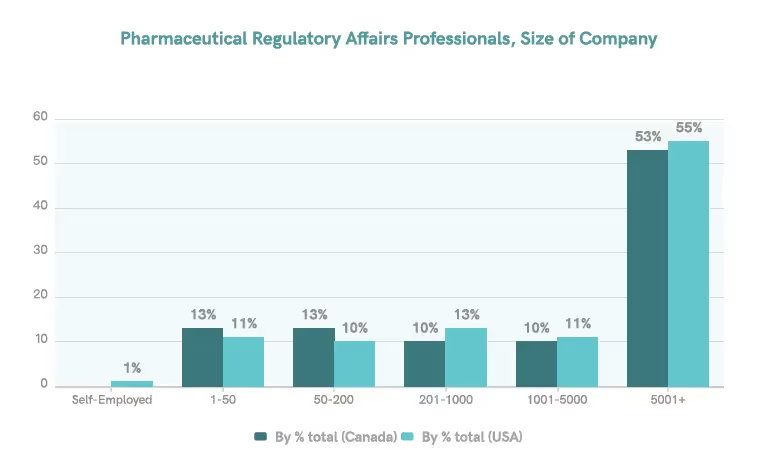
La plupart des départements des affaires réglementaires se trouvent dans les entreprises
Au Canada et aux États-Unis, la plupart des professionnels de la réglementation sont employés par des entreprises, entre 53 et 55 % d'entre eux travaillant pour des organisations comptant plus de 5 000 employés.5 Cela indique que l'échantillon de notre enquête est une représentation adéquate de la population cible.
Les équipes réglementaires sont petites mais puissantes grâce à l'automatisation
Notre enquête montre que les équipes chargées de la réglementation sont composées en moyenne de 10 personnes.
Avant la COVID-19, la majorité des professionnels de la réglementation travaillaient sur place. Cependant, les sociétés pharmaceutiques s'adaptent désormais à la « nouvelle normalité » d'un modèle de travail hybride en raison des nombreux avantages du travail à domicile. Tout au long de cette transition, la technologie basée sur le cloud a joué un rôle essentiel dans la communication des équipes et la gestion des documents, car les équipes avaient besoin d'un moyen efficace et sécurisé de continuer à travailler comme d'habitude dans leur nouvelle réalité de travail à distance.12 La technologie joue néanmoins un rôle essentiel dans l'automatisation des procédures réglementaires.
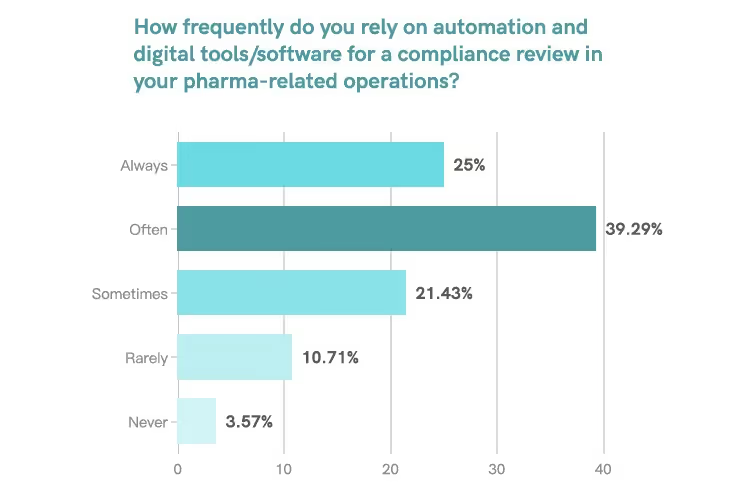
À la question « Sur une échelle de 1 « Jamais » à 5 « Toujours », à quelle fréquence comptez-vous sur l'automatisation et les outils/logiciels numériques pour l'évaluation de la conformité de vos opérations liées à l'industrie pharmaceutique ? » L'enquête montre que :
- 39,29 % des professionnels de la réglementation ont choisi 4 (souvent).
- 25,00 % n'ont pas choisi 5 (Toujours).
Cela signifie que plus de 64 % des personnes interrogées ont fréquemment utilisé des outils d'automatisation et numériques pour leur travail.
Pour garantir la sécurité des produits et atténuer le risque de pertes financières causées par des erreurs, les professionnels de la réglementation collaborent sur divers documents. 46,63 % des réponses des personnes interrogées incluaient des étiquettes, 21,43 % indiquaient le contenu du produit, 14,29 % incluaient des brochures et 14,29 % incluaient le contenu de l'emballage.
Les professionnels de la réglementation surveillent l'étiquetage et les descriptions des produits pour s'assurer qu'ils sont conformes à la sécurité des patients et à la réglementation.
La technologie accélère la conformité
Les professionnels de la réglementation garantissent la sécurité des produits pharmaceutiques grâce à des mesures de conformité. Idéalement, une précision de 100 % dans la documentation permet aux sociétés pharmaceutiques de réduire le risque de dépenses supplémentaires dues à des erreurs, telles que des amendes et des pénalités.

Ce chiffre n'inclut pas les autres produits hautement réglementés fabriqués par l'industrie, tels que les dispositifs médicaux, les vaccins, les substances contrôlées et les compléments alimentaires, qui sont soumis à des processus de conformité et de qualité rigoureux similaires, ce qui témoigne de l'ampleur du paysage.
Néanmoins, le processus de fabrication de ces produits reste complexe, long et coûteux, ce qui met en lumière les plus grandes craintes des professionnels de la réglementation : les problèmes de non-conformité tels que les rappels, les litiges juridiques, les sanctions, les amendes et les plaintes des consommateurs11.
Depuis 2000, l'augmentation des réglementations de conformité a compliqué les portefeuilles déjà complexes des entreprises, mais ce n'est pas sans raison. Le risque d'erreur entraîne des coûts importants, notamment : 14
- Une action corrective et préventive (CAPA) coûtant jusqu'à
10 000 millions de dollars américains.
- Letters of warning allant de 2 à 20 millions de dollars américains selon que des changements de production sont nécessaires.
- Décrets constants atteignant jusqu'à 100 millions de dollars américains.
Pour réduire ces coûts, les équipes chargées de la réglementation examinent régulièrement divers documents très sensibles, tels que les formules des produits, les instructions d'utilisation (IFU), les étiquettes et les cartons, et ce, souvent manuellement ou visuellement. Ces processus de révision sont méticuleux et prennent beaucoup de temps, dans le but de maintenir la conformité et d'assurer une surveillance constante pour s'assurer que seuls les changements prévus ont été introduits.
Aujourd'hui, la technologie permet d'améliorer les méthodes de révision :

La technologie optimise les indicateurs de réussite réglementaire
Les indicateurs de qualité jouent un rôle essentiel dans l'évaluation et l'amélioration de l'efficacité, de l'efficience et de la conformité des processus réglementaires au sein de l'industrie. Ils fournissent également des mesures quantitatives pour évaluer
les performances de fabrication et de distribution des produits pharmaceutiques.
Optimisation de l'efficacité en termes de temps
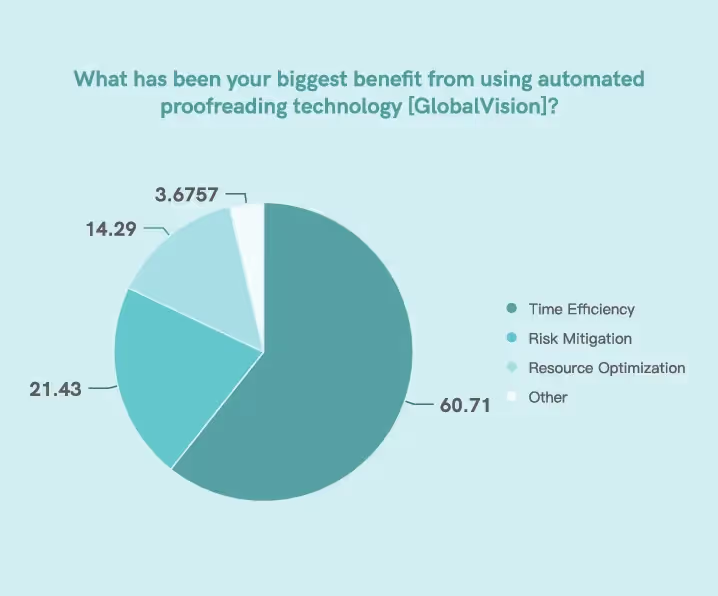
Selon notre enquête, l'automatisation et la technologie numérique ont aidé les professionnels de la réglementation à optimiser divers indicateurs clés de performance (KPI), 60,71 % des personnes interrogées déclarant qu'ils sont devenus plus
gain de temps grâce à la mise en œuvre de la technologie.
Accélérer les délais de soumission des demandes réglementaires
Calendrier des soumissions réglementaires : L'automatisation augmente la productivité des soumissions réglementaires.11 Les indicateurs collectent le temps nécessaire à la préparation et à la soumission des documents réglementaires, tels que les demandes de nouveaux médicaments expérimentaux (IND), les demandes de nouveaux médicaments (NDA) et les demandes d'autorisation de mise sur le marché (MAA).
Allumer le risque de non-conformité
Conformity monitoring : Les technologies automatisées permettent aux professionnels de la réglementation de saisir de plus grandes quantités de données et de prendre des mesures réglementaires plus rapidement.11 Les problèmes peuvent inclure des écarts, des erreurs de non-conformité et des mesures correctives pour le respect des exigences réglementaires et des normes du secteur.
Améliorer l'efficacité du cadre réglementaire
Grâce à la technologie et à l'innovation, la plupart des personnes interrogées affirment avoir pu se concentrer sur un plus grand nombre de projets et de tâches centrées sur l'humain.

Opportunités pour encore plus d'efficacité grâce à l'IA
Dans leurs examens, les agences de réglementation mettent de plus en plus l'accent sur les systèmes de qualité et la maturité des processus.15
Aujourd'hui, l'intelligence artificielle (IA) et l'apprentissage automatique (ML) sont les principales technologies utilisées pour les procédures de conformité16. L'IA et le ML analysent de grands ensembles de données et extraient des modèles et des prévisions qui peuvent être répétés dans les processus réglementaires. L'IA et le ML aident les professionnels de la réglementation à identifier les anomalies et les problèmes de non-conformité, et même à automatiser les tâches répétitives.
De plus, l'IA et le ML permettent d'automatiser les opérations suivantes16 :
- Evaluation des risques : Prescrire les risques liés à la conformité dans les données après la création d'un plan de correction.
- Crisis management : Identifier les incidents de sécurité potentiels, tels que les violations de données, et les moyens de les contrer.
- Analyses prédictives : Prévoir les tendances à long terme des risques de conformité, leur impact et les moyens de les prévenir et de les atténuer.
Perspectives d'avenir : l'automatisation au-delà de la conformité
Des technologies améliorant la conformité pour continuer à se développer
À l'avenir, l'automatisation et la technologie numérique continueront de bénéficier aux professionnels des affaires réglementaires à long terme. Les professionnels de la réglementation adoptent de plus en plus les technologies d'automatisation et les solutions numériques pour améliorer leurs processus.
D'ici 2030, la technologie réglementaire augmentera considérablement la demande du marché.17
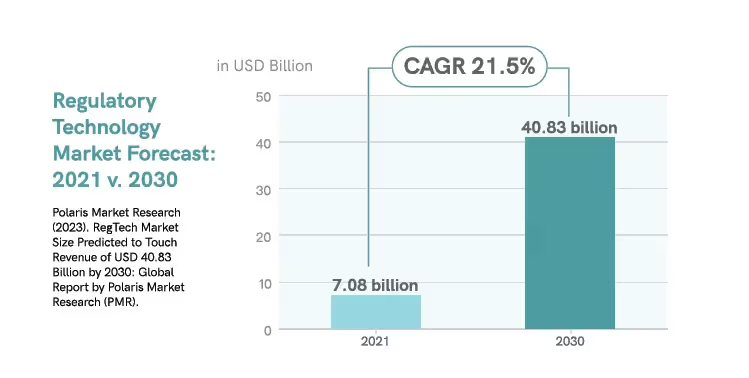
À mesure que le paysage réglementaire évolue, l'industrie continue d'explorer d'autres applications de la technologie d'automatisation.
La conformité devrait aller au-delà des audits et des révisions et être mise en œuvre dans les activités commerciales.16 L'automatisation de la conformité sera couplée à d'autres départements pour modifier les politiques et prendre des décisions centrées sur les données. Cela minimisera considérablement le risque de non-conformité au niveau de l'entreprise.
Harmonisation des réglementations mondiales et des directives plus strictes
À mesure que la recherche pharmaceutique continue de se développer, les réglementations devraient devenir encore plus strictes. Cependant, au cours des 10 prochaines années, les professionnels de la réglementation prévoient une harmonisation plus globale des réglementations : la technologie peut créer des opportunités tout au long de la chaîne de valeur réglementaire afin d'améliorer la rapidité, la précision et la qualité des activités réglementaires11.
Cette prévision correspond à une étude européenne menée auprès de 217 personnes interrogées qui montre que 53 % des sociétés pharmaceutiques ont été touchées négativement par le BREXIT en 2020.18
À l'avenir, la technologie devrait combler les lacunes en matière de communication entre les agences de réglementation mondiales et simplifier le processus d'approbation.


