Der Aufstieg der Automatisierungstechnik in regulatorischen Angelegenheiten

Zusammenfassung
Neue Technologien ermöglichen es Pharmaunternehmen, die Produktentwicklung und Vermarktung schneller als je zuvor zu beschleunigen. In diesem Bericht wird erörtert, wie sich Technologie, insbesondere Automatisierung und digitale Technologien, auf regulatorische Angelegenheiten in der Pharmaindustrie auswirken.
Die Ergebnisse kamen zu dem Schluss, dass Automatisierung und digitale Technologien den regulatorischen Fachleuten helfen, die Zeit für Korrekturlesen und Überprüfung erheblich zu verkürzen, Überarbeitungen zu minimieren und Produkte schneller auf den Markt zu bringen.
Darüber hinaus gibt es Belege dafür, dass diese Technologien den Aufsichtsbehörden helfen, bei der Skalierung der Fertigung kosteneffizienter zu sein, was sich letztlich positiv auf ihr Geschäftsergebnis auswirkt.
Schließlich wird untermauert, dass Automatisierung und digitale Technologien dazu beitragen, dass Sicherheitshinweise für Verbraucher vorhanden sind.
Mit Blick auf die Zukunft prognostiziert die Studie mit hinreichender Sicherheit, dass Automatisierung und digitale Technologie in allen Abteilungen der Pharmaindustrie weiter zunehmen und gleichzeitig die zukünftige globale Ausrichtung regulatorischer Angelegenheiten erheblich beeinflussen werden.
Orientierung im regulatorischen Umfeld
In jedem Land gibt es eine Aufsichtsbehörde, die sicherstellt, dass Verbraucher vertrauenswürdige und zuverlässige Gesundheitsprodukte kaufen. Die Vereinigten Staaten Lebensmittel- und Arzneimittelbehörde (FDA) hält eine Amt für regulatorische Angelegenheiten (ORA) zur Regulierung von Produkten im Zusammenhang mit der öffentlichen Gesundheit.1 Ähnlich in Kanada, Gesundheit Kanada moduliert Produkte durch ihre Branche für Gesundheitsprodukte und Lebensmittel (HPFB). 2 In der Europäischen Union ist die Europäische Arzneimittel-Agentur (EMA) steht an der Spitze des Arzneimittellebenszyklus der Region. 3 Da die Aufsichtsbehörden eingerichtet sind, können weniger Medikationsfehler — Fälle unsachgemäßer Arzneimittelanwendung — auftreten.
Statistiken zeigen jedoch ein anderes Bild. Eine FDA-Statistik von Harvard Health Publishing berichtet, dass die Behörde in den letzten zehn Jahren über 14.000 Arzneimittelrückrufe verzeichnete, was einem ungefähren Durchschnitt von vier Arzneimittelrückrufen pro Tag entspricht.4

Unternehmen verlassen sich auf Experten für regulatorische Angelegenheiten, um sicherzustellen, dass Produkte den gesetzlichen Anforderungen entsprechen. Große Mengen von Arzneimitteln werden jedoch kontinuierlich mit Fehlern wie einer falschen Dosierungskennzeichnung auf den Markt gebracht. Um dem entgegenzuwirken, nutzen Unternehmen innovative Automatisierungs- und digitale Technologien, um regulatorische Prozesse in allen Arbeitsabläufen zu rationalisieren, für die ansonsten zahlreiche manuelle Inspektionen erforderlich wären.
In diesem Bericht wird untersucht, wie Fachleute für regulatorische Angelegenheiten in der Pharmaindustrie diese Technologien einsetzen, um die Vorschriften einzuhalten und die Verbraucher zu schützen.
Methodologie
Unsere Forschung bestand aus gemischten Methoden und befasste sich mit Fächern, die sich auf regulatorische Angelegenheiten spezialisiert haben.
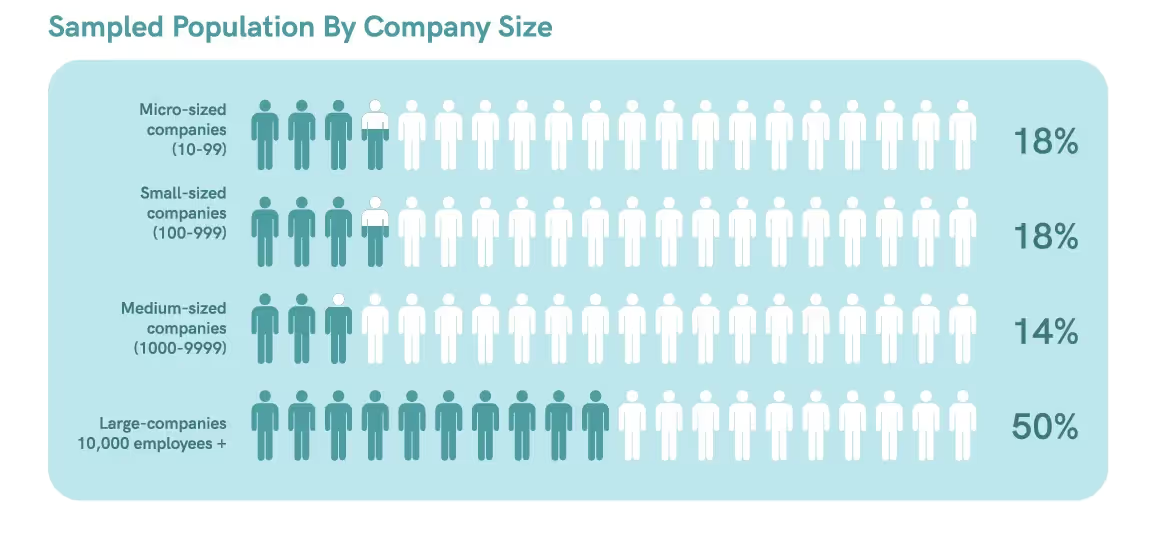
In unserer Umfrage wurden Daten von 28 verschiedenen Fachleuten für regulatorische Angelegenheiten aus Unternehmen unterschiedlicher Größe gesammelt. Die Umfrage identifizierte Trends in Bezug auf die Auswirkungen von Automatisierung und digitalen Technologien auf Compliance-Verfahren und Erfolgskennzahlen.
Demografie

Geografischer Geltungsbereich
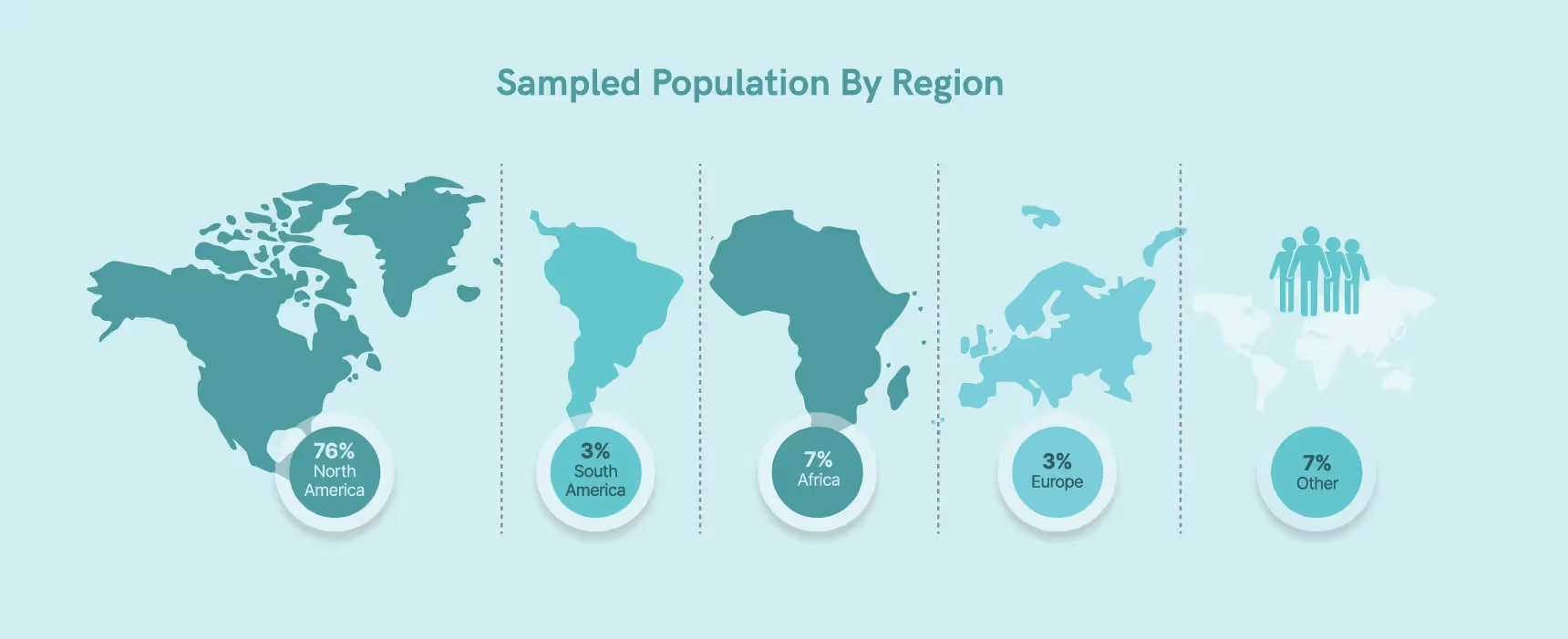
Unser Fokus auf die Branche liegt hauptsächlich in der westlichen Region, wobei 76% unserer Befragten in Nordamerika ansässig sind (die übrigen Befragten waren wie folgt: 7% Afrika, 3% Europa, 3% Südamerika, 7% Andere).
In ähnlicher Weise machen Nordamerika und Europa laut einem Bericht der RAPS (Regulatory Affairs Professionals Society) aus dem Jahr 2021 etwa 66% des globalen Pharmamarktes aus.5
Darüber hinaus haben wir in einer sorgfältig kuratierten Bibliothek externe Marktforschungen zu einer ähnlichen demografischen Gruppe durchgeführt, die sich makroökonomisch auf die Branche auswirkt.
Die Pharmaindustrie verstehen
Bevor Sie sich eingehender mit regulatorischen Angelegenheiten befassen, müssen Sie die Pharmaindustrie verstehen. Sie ist für die Entwicklung, Herstellung und den Vertrieb von Gesundheitsmedikamenten verantwortlich und arbeitet innerhalb eines komplexen regulatorischen Rahmens.
Einblicke in den Markt
Trotz ihrer Komplexität wächst die globale Pharmaindustrie weiterhin rasant, wobei die kommerziell erfolgreichsten Arzneimittel jeweils über 1 Milliarde US-Dollar pro Jahr erwirtschaften können.6
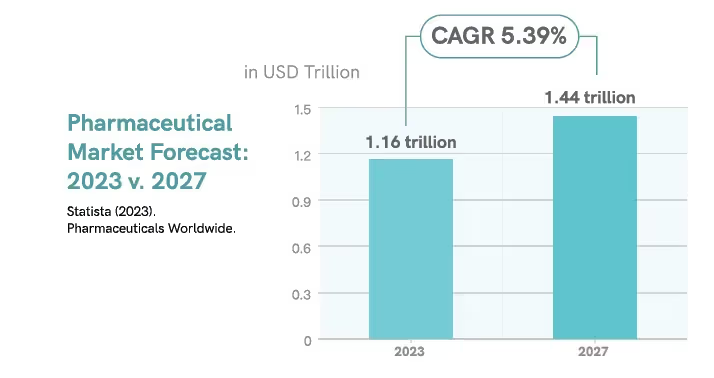
Der Pharmamarkt wird voraussichtlich ein Marktvolumen von erreichen
1,16 Billionen USD im Jahr 2023, wobei die durchschnittliche jährliche Wachstumsrate (CAGR) von rund 5,39% bis 2027 auf 1,44 Billionen USD ansteigt.
Obwohl diese Prognosen vielversprechend erscheinen, geben die aktuellen Trends in der Pharmaindustrie Anlass zu einiger Besorgnis über die variablen Kosten und Einsparmöglichkeiten der Branche, wie z. B. die Anpassung der Nutzer an den technologischen Fortschritt, die Herausforderungen auf dem Arbeitsmarkt und die Inflation.8

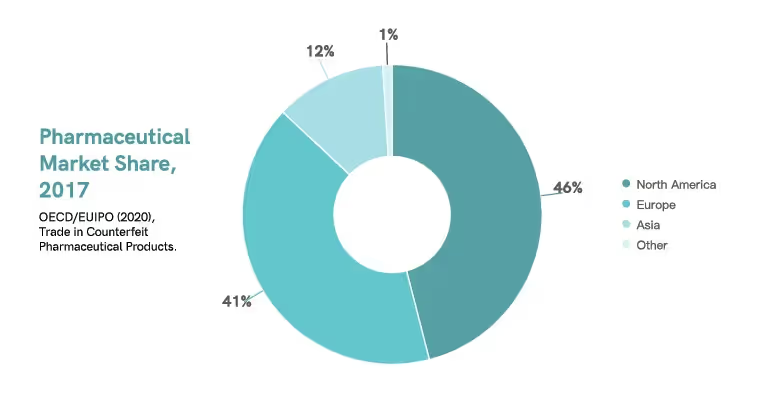
Einer Studie aus dem Jahr 2017 zufolge sättigte Nordamerika rund 46% des globalen Pharmamarktes, gefolgt von Europa mit etwa 41% und Asien mit etwa 12% .9 Derzeit dominieren die Vereinigten Staaten und Europa den globalen Pharmamarkt.5
Kategorien für Unternehmen
Die Branche zeichnet sich durch verschiedene Unternehmen aus, die sich auf Gesundheits-, Biowissenschaften- und Biotech-Praktiken spezialisiert haben. Dazu gehören:
- Forschungsorientierte Pharmaunternehmen
- Generikahersteller
- Auftragsentwicklungs- und Fertigungsorganisationen (CDMOs)
- Biopharmazeutische Unternehmen
Forschungsorientierte Pharmaunternehmen

Diese Unternehmen konzentrieren sich auf Forschung und Entwicklung (F&E), um neue Arzneimittel zu entdecken und zu entwickeln, und investieren stark in wissenschaftliche Forschung und klinische Studien.
Generikahersteller

Diese Unternehmen produzieren und vermarkten generische Versionen von Markenmedikamenten nach Ablauf des Patentschutzes. Sie wollen erschwinglichere Alternativen zu Markenmedikamenten anbieten.
Auftragsentwicklungs- und Fertigungsorganisationen (CDMOs))

Diese Unternehmen bieten ausgelagerte Dienstleistungen für die Arzneimittelentwicklung, -formulierung, -herstellung und -verpackung für Pharmaunternehmen an.
Biopharmazeutische Unternehmen

Diese Unternehmen konzentrieren sich auf die Entwicklung von Medikamenten, die aus biologischen Quellen wie lebenden Organismen, Zellen, Proteinen und Antikörpern gewonnen werden.
Die Branche entwickelt sich mit neuen Hybridmodellen der oben genannten Unternehmen weiter. Daher schließen sich diese Unternehmenstypen nicht gegenseitig aus.
Die Stakeholder der Pharmaindustrie gehen über den Endverbraucher hinaus
Pharmaunternehmen sind für die Befriedigung von drei Hauptkundengruppen verantwortlich: 10
- Patienten: Aufgrund regulatorischer Beschränkungen haben Pharmaunternehmen nur begrenzte Möglichkeiten, direkt mit Patienten in Kontakt zu treten.
- Personal mit direktem Patientenkontakt: Dazu gehören Allgemeinmediziner (GPs),
Fachärzte, Apotheker und Krankenschwestern.
- Aufsichtsbehörden: Zu diesen Aufsichtsbehörden gehören die FDA und Health Canada.
Thema im Rampenlicht: Der Experte für regulatorische Angelegenheiten
Die Abteilung für regulatorische Angelegenheiten gewährleistet die Sicherheit, Wirksamkeit und Qualität pharmazeutischer Produkte.11 Von den über 98.000 Fachleuten weltweit sind 65% auf die Überwachung pharmazeutischer Produkte spezialisiert.5
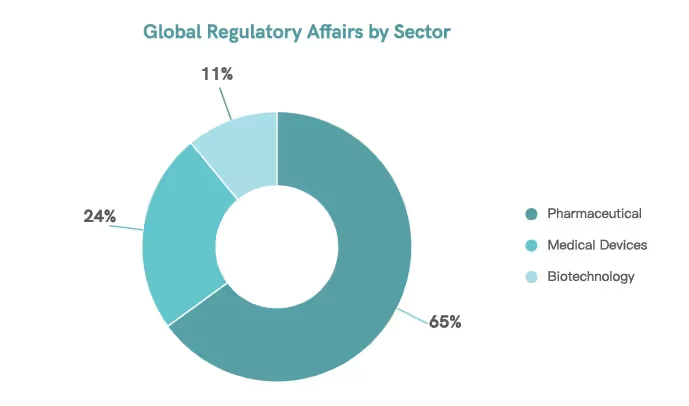
Regulatorische Experten spielen eine wichtige Rolle bei der Bewältigung der Herausforderungen globaler regulatorischer Anforderungen und stellen sicher, dass Unternehmen die Standards einhalten. Dies wird zum Eckpfeiler der Produktentwicklung und Vermarktung. Durch ihre Arbeit sind Unternehmen in der Lage, ihre Produkte zu schützen und die öffentliche Gesundheit zu verbessern.11
Die meisten Abteilungen für regulatorische Angelegenheiten befinden sich in Unternehmen auf Unternehmensebene
In Kanada und den Vereinigten Staaten sind die meisten Regulierungsfachkräfte in Unternehmen angestellt, wobei etwa 53-55% von ihnen für Organisationen mit über 5.000 Mitarbeitern arbeiten.5 Dies deutet darauf hin, dass unsere Umfragestichprobe die Zielgruppe angemessen wiedergibt.
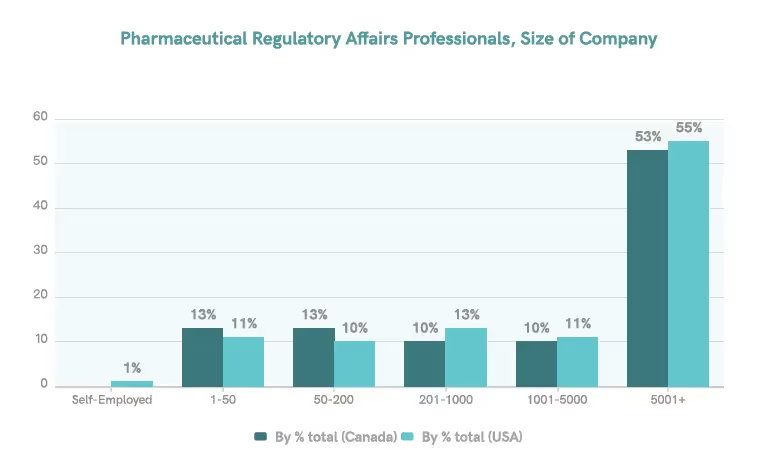
Regulatorische Teams sind klein, aber dank Automatisierung mächtig
Unsere Umfrage zeigt, dass die regulatorischen Teams im Durchschnitt aus 10 Personen bestehen.
Vor COVID-19 arbeitete die Mehrheit der regulatorischen Fachkräfte vor Ort. Aufgrund zahlreicher Leistungen, die das Arbeiten von zu Hause aus bieten, stellen sich Pharmaunternehmen derzeit jedoch auf die „neue Normalität“ eines hybriden Arbeitsmodells ein. Während dieses Übergangs spielte cloudbasierte Technologie eine entscheidende Rolle bei der Teamkommunikation und dem Dokumentenmanagement, da die Teams eine effiziente und sichere Methode brauchten, um in ihrer neuen mobilen Arbeitswelt „business as usual“ weiterführen.12 Dennoch spielt Technologie eine entscheidende Rolle bei der Automatisierung behördlicher Verfahren.
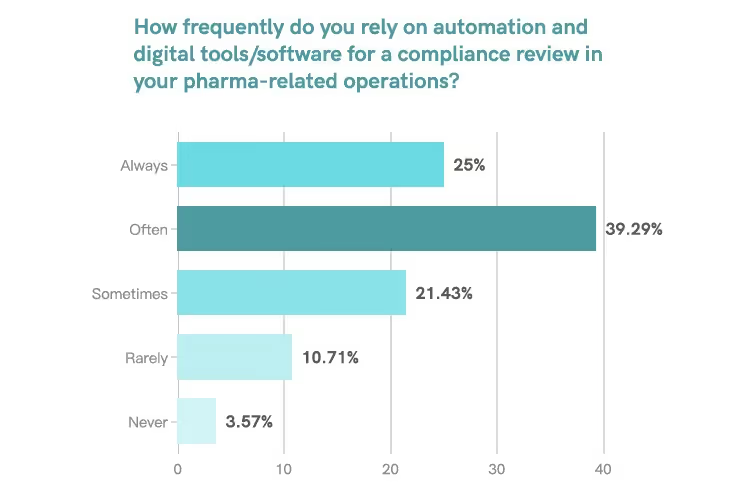
Auf die Frage: „Wie oft verlassen Sie sich auf einer Skala von 1 ‚Nimmer' bis 5 ‚Immer' auf Automatisierung und digitale Tools/Software für eine Compliance-Überprüfung in Ihren pharmazeutischen Abläufen?“ Die Umfrage zeigt, dass:
- 39,29% der Aufsichtsfachleute entschieden sich für 4 (häufig).
- 25,00% entschieden sich für 5 (Immer).
Das bedeutet, dass Über 64% der Befragten nutzten häufig Automatisierung und digitale Tools für ihre Arbeit.
Um die Produktsicherheit zu gewährleisten und das Risiko finanzieller Verluste aufgrund von Fehlern zu minimieren, arbeiten die Aufsichtsbehörden an verschiedenen Dokumenten zusammen. 46,63% der Befragten enthielten Etiketten, gefolgt von 21,43% mit Produktinhalten, 14,29% enthielten Packungsbeilagen und 14,29% beinhalteten Verpackungsinhalte.
Aufsichtsbehörden überwachen die Produktkennzeichnung und -beschreibungen, um sicherzustellen, dass sie die Patientensicherheit und die Vorschriften einhalten.
Technologie beschleunigt die Einhaltung von Vorschriften
Aufsichtsbehörden gewährleisten die Sicherheit pharmazeutischer Produkte durch Compliance-Maßnahmen. Im Idealfall stellt eine hundertprozentige Genauigkeit der Dokumentation sicher, dass Pharmaunternehmen das Risiko zusätzlicher Ausgaben aufgrund von Fehlern wie Bußgeldern und Strafen minimieren.

In dieser Zahl sind andere stark regulierte Produkte der Branche nicht enthalten, wie Medizinprodukte, Impfungen, kontrollierte Substanzen und Nahrungsergänzungsmittel, die ähnlich strengen Compliance- und Qualitätsprozessen unterliegen, was dem Ausmaß der Landschaft entspricht.
Dennoch ist der Herstellungsprozess dieser Produkte nach wie vor komplex, zeitaufwändig und teuer, was die größten Befürchtungen der Aufsichtsbehörden unterstreicht: Verstöße gegen die Vorschriften wie Rückrufe, Rechtsstreitigkeiten, Sanktionen, Bußgelder und Verbraucherbeschwerden.11
Seit dem Jahr 2000 hat die Zunahme der Compliance-Vorschriften die ohnehin komplexen Portfolios der Unternehmen kompliziert gemacht, wenn auch nicht ohne Grund. Das Fehlerrisiko ist mit hohen Kosten verbunden, darunter:
- Eine Korrektur- und Präventivmaßnahme (CAPA) kostet bis zu
10.000 Millionen USD.
- Warnbriefe zwischen 2 und 20 Millionen US-Dollar, je nachdem, ob Produktionsänderungen erforderlich sind.
- Ständige Dekrete erreicht bis zu 100 Millionen USD.
Um diese Kosten zu minimieren, überprüfen die regulatorischen Teams routinemäßig eine Vielzahl hochsensibler Dokumente — wie Produktrezepturen, Gebrauchsanweisungen (IFUs), Etiketten und Kartons — und dies häufig manuell oder visuell. Diese Überprüfungsverfahren sind akribisch und zeitaufwändig, mit dem Ziel, die Einhaltung der Vorschriften zu gewährleisten und ständig zu überwachen, um sicherzustellen, dass nur beabsichtigte Änderungen vorgenommen wurden.
Heute ermöglicht die Technologie verbesserte Überprüfungsmethoden:

Technologie optimiert regulatorische Erfolgskennzahlen
Qualitätskennzahlen spielen eine entscheidende Rolle bei der Bewertung und Verbesserung der Effektivität, Effizienz und Einhaltung regulatorischer Prozesse in der Branche. Sie bieten auch quantitative Messgrößen zur Bewertung
die Herstellungs- und Vertriebsleistung pharmazeutischer Produkte.
Maximierung der Zeiteffizienz
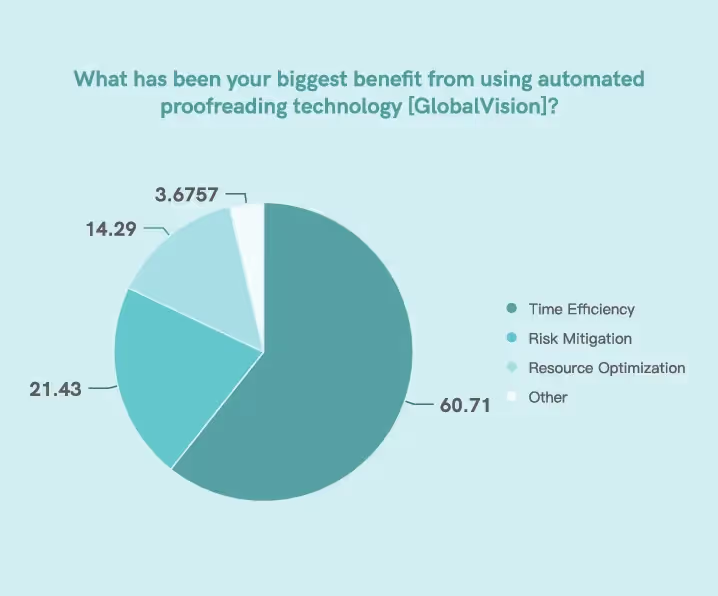
Unserer Umfrage zufolge haben Automatisierung und digitale Technologie den Aufsichtsbehörden dabei geholfen, verschiedene Key Performance Indicators (KPIs) zu maximieren. 60,71% der Befragten gaben an, dass sie mehr geworden sind
zeiteffizient bei der Implementierung von Technologie.
Verkürzung der Fristen für behördliche Einreichungen
Zeitpläne für behördliche Einreichungen: Die Automatisierung erhöht die Produktivität bei Zulassungsanträgen. 11 Anhand der Kennzahlen wird erfasst, wie viel Zeit für die Vorbereitung und Einreichung von Zulassungsdokumenten wie Anträgen auf neue Prüfpräparate (IND), Anträge für neue Arzneimittel (NDA) und Zulassungsanträge (MAA) aufgewendet werden muss.
Minderung des Risikos von Verstößen
Überwachung der Einhaltung der Vorschriften: Automatisierte Technologien ermöglichen es behördlichen Fachleuten, größere Datenmengen zu erfassen und regulatorische Maßnahmen schneller zu ergreifen.11 Zu den Problemen gehören Abweichungen, Fehler bei der Einhaltung von Vorschriften und Abhilfemaßnahmen zur Einhaltung behördlicher Anforderungen und Industriestandards.
Verbesserung der Wirksamkeit des regulatorischen Rahmens
Dank Technologie und Innovation gaben die meisten Befragten an, sich auf mehr Projekte und menschenorientierte Aufgaben konzentrieren zu können.

Möglichkeiten für noch mehr Effizienz mit KI
Bei ihren Überprüfungen haben sich die Aufsichtsbehörden zunehmend auf Qualitätssysteme und Prozessreife konzentriert.15
Heute sind künstliche Intelligenz (KI) und maschinelles Lernen (ML) die wichtigsten Technologien, die für Compliance-Verfahren verwendet werden.16 KI und ML analysieren große Datenmengen und extrahieren Muster und Vorhersagen, die in regulatorischen Prozessen wiederholt werden können. KI und ML helfen regulatorischen Fachleuten dabei, Anomalien und Verstöße zu erkennen und sogar sich wiederholende Aufgaben zu automatisieren.
Darüber hinaus helfen KI und ML dabei, Folgendes zu automatisieren:16
- Risikobeurteilung: Beschreibung von Compliance-Risiken in Daten nach der Erstellung eines Korrekturplans.
- Krisenmanagement: Identifizierung potenzieller Sicherheitsvorfälle wie Datenschutzverletzungen und wie diesen begegnet werden kann.
- Prädiktive Analytik: Prognose langfristiger Trends von Compliance-Risiken, ihrer Auswirkungen und Möglichkeiten, sie zu verhindern und zu mindern.
Zukunftsausblick: Automatisierung geht über Compliance hinaus
Technologien, die die Einhaltung von Vorschriften fördern, werden weiter expandieren
Mit Blick auf die Zukunft werden Automatisierung und digitale Technologie den Fachleuten für regulatorische Angelegenheiten auch langfristig zugute kommen. Regulierungsexperten setzen zunehmend auf Automatisierungstechnik und digitale Lösungen, um ihre Prozesse zu verbessern.
Bis 2030 wird regulatorische Technologie die Marktnachfrage deutlich steigen.17
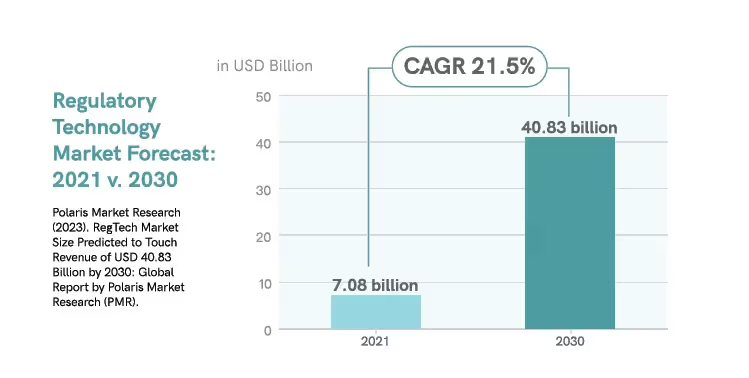
Da sich das regulatorische Umfeld weiterentwickelt, wird die Branche auch weiterhin nach anderen Anwendungen der Automatisierungstechnik suchen.
Es wird prognostiziert, dass die Einhaltung von Vorschriften über Audits und Überarbeitungen hinausgeht und in Geschäftsaktivitäten umgesetzt wird.16 Die Compliance-Automatisierung wird mit anderen Abteilungen kombiniert, um Richtlinien zu ändern und datenzentrierte Entscheidungen zu treffen. Dadurch wird das Risiko einer Nichteinhaltung der Vorschriften auf Unternehmensebene drastisch minimiert.
Harmonisierung globaler Vorschriften und strengerer Richtlinien
Da die pharmazeutische Forschung weiter expandiert, werden die Vorschriften voraussichtlich noch strenger werden. In den nächsten 10 Jahren prognostizieren Experten jedoch, dass es zu einer stärkeren globalen Angleichung der Vorschriften kommen wird. Technologie kann entlang der gesamten regulatorischen Wertschöpfungskette Chancen eröffnen, um die Geschwindigkeit, Genauigkeit und Qualität regulatorischer Aktivitäten zu verbessern.11
Diese Prognose entspricht einer europäischen Studie mit 217 Befragten, aus der hervorgeht, dass 53% der Pharmaunternehmen im Jahr 2020 negativ vom BREXIT betroffen waren. 18
In Zukunft wird erwartet, dass die Technologie Kommunikationslücken zwischen den globalen Aufsichtsbehörden überbrücken und den Zulassungsprozess vereinfachen wird.


