Transformation numérique pour la qualité des emballages pharmaceutiques

Les nombreux éléments de la localisation
Tous les aspects de la production pharmaceutique, y compris les affaires réglementaires, l'emballage et la conformité après commercialisation, doivent respecter les normes de contrôle qualité les plus strictes établies par des agences telles que la FDA et l'EMA. Alors que la mondialisation continue d'étendre la taille des marchés, les sociétés pharmaceutiques doivent coordonner la localisation de chaque produit qu'elles commercialisent. Ils doivent s'assurer que leurs produits sont communiqués et mis à disposition dans plusieurs langues tout en respectant les directives et les exigences de conformité de chaque région dans laquelle ils opèrent. Outre les traductions, la localisation inclut l'ajustement des préférences de couleur, des unités de mesure, des formats de date, des illustrations et d'autres éléments pour refléter les différents marchés. Dans l'industrie pharmaceutique, plus d'informations sont produites à chaque étape du cycle de vie du produit que dans tout autre segment de marché. La documentation juridique, les brochures, les boîtes, les encarts et tous les autres contenus doivent être développés pour répondre aux besoins uniques d'une zone géographique particulière, ce qui pose des défis aux équipes réglementaires lorsqu'il s'agit de garantir l'exactitude du contenu à chaque étape du flux de travail. En outre, étant donné la rapidité avec laquelle les nouveaux médicaments doivent être publiés, il est difficile de s'assurer qu'aucune erreur n'a été introduite lors de l'adaptation du contenu aux marchés locaux. Cela complique considérablement un processus où la marge d'erreur est déjà faible, car une localisation incorrecte peut entraîner des problèmes juridiques potentiels et une baisse des revenus sur les marchés étrangers.
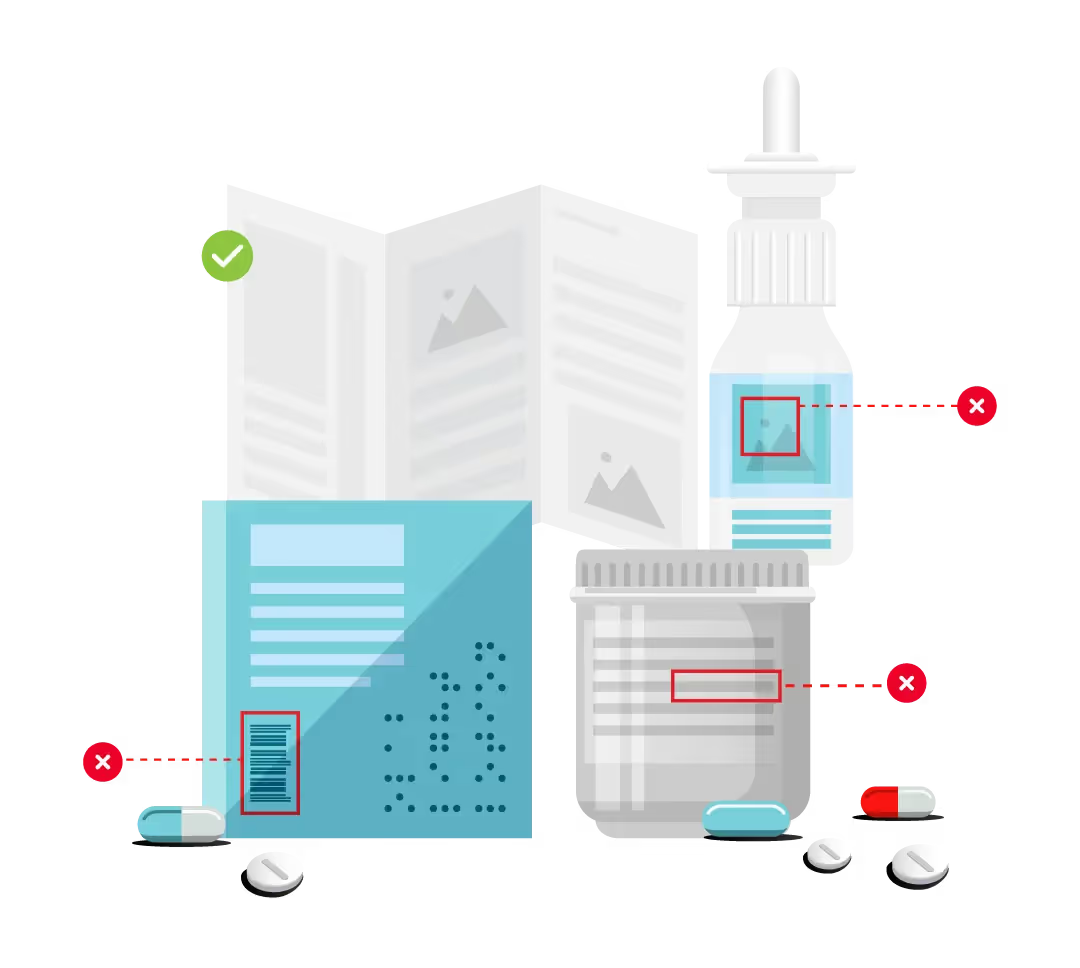
Les erreurs d'emballage sont devenues l'une des principales causes de rappels sur le marché pharmaceutique mondial, car l'emballage des produits continue d'être adapté pour répondre aux exigences de localisation. Qu'il s'agisse de fautes d'orthographe apparaissant lors de la traduction de langues étrangères ou de défauts d'illustration, le risque de laisser passer une erreur d'emballage est élevé. À mesure que la taille du marché augmente et que les sociétés pharmaceutiques deviennent plus dynamiques, les charges de travail réglementaires deviennent encore plus complexes et difficiles à gérer. Les travailleurs qualifiés sont souvent en forte demande et en pénurie, ce qui crée un risque d'erreur dans des domaines tels que la conformité, la gestion des illustrations et l'étiquetage. Pour faire face à cette tendance croissante, de plus en plus d'entreprises introduisent des solutions numériques couvrant plusieurs aspects du flux de travail pharmaceutique.
Utiliser la technologie pour fonctionner à grande échelle
L'un des plus grands défis auxquels sont confrontés les professionnels du contrôle qualité et de la réglementation est la quantité de données qu'ils doivent gérer au quotidien. Les affaires réglementaires jouent un rôle essentiel en faisant le lien entre les agences de santé et les différents services de l'entreprise afin de s'assurer que toutes les données accumulées sont correctement transcrites pour créer et commercialiser le médicament. Qu'il s'agisse d'obtenir l'approbation d'un nouveau produit ou de s'assurer que les directives correctes de la FDA sont appliquées à l'étiquetage en termes de contenu et de mise en forme, le service des affaires réglementaires intervient dans de nombreux aspects de la production. En outre, des révisions doivent être effectuées à chaque étape du flux de création des fichiers pour s'assurer que les informations restent exactes et conformes à ce qui a été approuvé.

L'un des principaux moyens de gérer efficacement les charges de travail croissantes liées à la mondialisation consiste à exploiter des solutions technologiques qui permettent aux affaires réglementaires de l'industrie pharmaceutique de fonctionner à grande échelle. En matière de relecture, les processus manuels ne sont plus réalisables compte tenu de la taille et de la rapidité avec lesquelles les produits doivent être livrés. UNE numérique système de contrôle qualité peut être utilisé pour vérifier l'exactitude du contenu des fichiers numériques et des matériaux d'emballage imprimés, éliminant ainsi le besoin de relecture manuelle et les inefficacités qui en découlent.
Relecture numérique pour le flux de travail pharmaceutique
La relecture automatisée peut être mise en œuvre à chaque étape du flux de travail pharmaceutique afin de garantir qu'aucune erreur n'a été créée ou introduite. Tout d'abord, les exigences relatives aux produits et aux médicaments sont soumises aux organismes de réglementation qui compilent ensuite les informations dans des documents d'information destinés à être examinés par l'organisme de réglementation approprié. La mise en œuvre d'un système de contrôle qualité numérique à ce stade permettrait de garantir que tous les documents de copie sont exempts d'erreurs et exacts pour les révisions internes et les soumissions réglementaires en inspectant automatiquement les documents contenant beaucoup de texte caractère par caractère. Au stade de la création des illustrations, les fichiers d'illustrations peuvent être inspectés automatiquement pour s'assurer qu'aucune erreur n'a été introduite lors du processus de création du fichier. Ces erreurs incluent souvent des erreurs de conformité telles que des erreurs de logo, des informations incorrectes et des défauts de codes-barres. Les inspections numériques peuvent être poursuivies au fur et à mesure que les fichiers sont édités pour s'assurer qu'aucune erreur involontaire n'a été ajoutée.
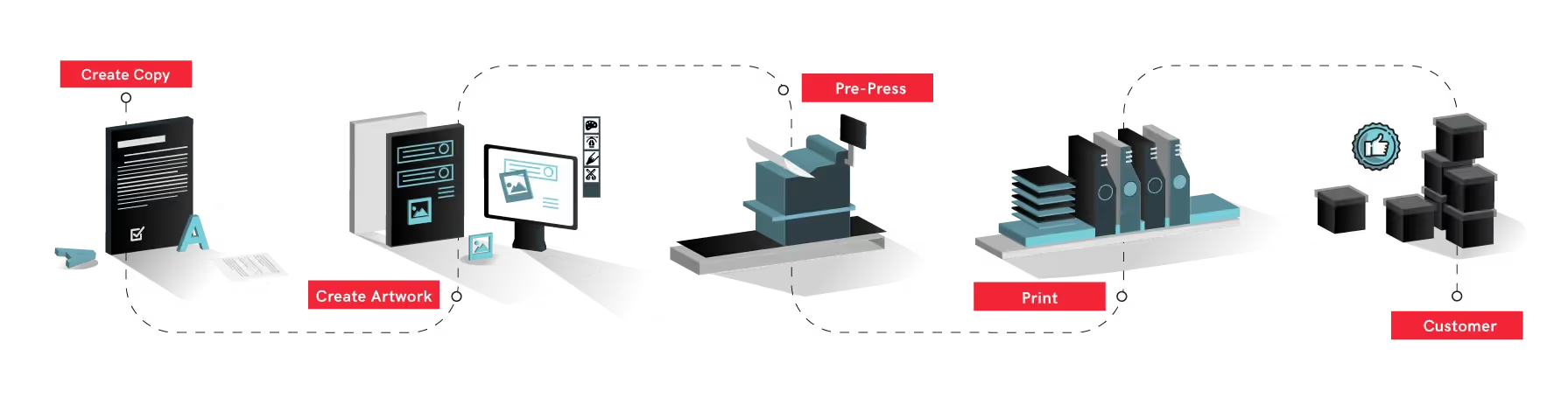
Il est impératif que le contenu reste exact à chaque étape du processus, dans tous les départements. Une solution de relecture numérique permet également de suivre les changements de version entre les services, réduisant ainsi les longs cycles d'approbation et les délais de mise sur le marché. Au stade final, le logiciel de contrôle qualité numérique peut comparer automatiquement les fichiers approuvés aux épreuves des fournisseurs avant d'être imprimés, garantissant ainsi que les produits arrivent sur le marché avec un emballage totalement exempt d'erreurs. Les systèmes numériques améliorent encore l'efficacité globale du flux de travail des emballages pharmaceutiques en réduisant les cycles de révision et en détectant les erreurs plus tôt dans le processus, aussi petites soient-elles.
« Pour éviter les rappels et garantir une bonne qualité d'étiquetage tout en restant conforme... vous ne pouvez pas vous en occuper vous-même. Vous avez besoin d'un outil comme GlobalVision, non seulement pour être plus rapide mais aussi plus sûr. »
Caroline Sell
Responsable des affaires réglementaires Produits pharmaceutiques Merz
Un autre défi pour les professionnels de la réglementation de l'industrie pharmaceutique est la gestion du contenu en langues étrangères. Alors que les produits médicaux continuent de faire leur entrée sur les marchés étrangers, les emballages, les encarts contenant beaucoup de texte et les instructions d'utilisation doivent être traduits dans différentes langues. Les traductions sont souvent confiées à des sociétés externes qui peuvent traduire jusqu'à 2 000 mots par jour, ce qui laisse une marge d'erreur importante. Les solutions technologiques peuvent aider à gérer cela efficacement en améliorant la gestion des documents, le contrôle des versions et l'assurance qualité grâce à une relecture automatique prenant en charge de nombreuses langues étrangères.
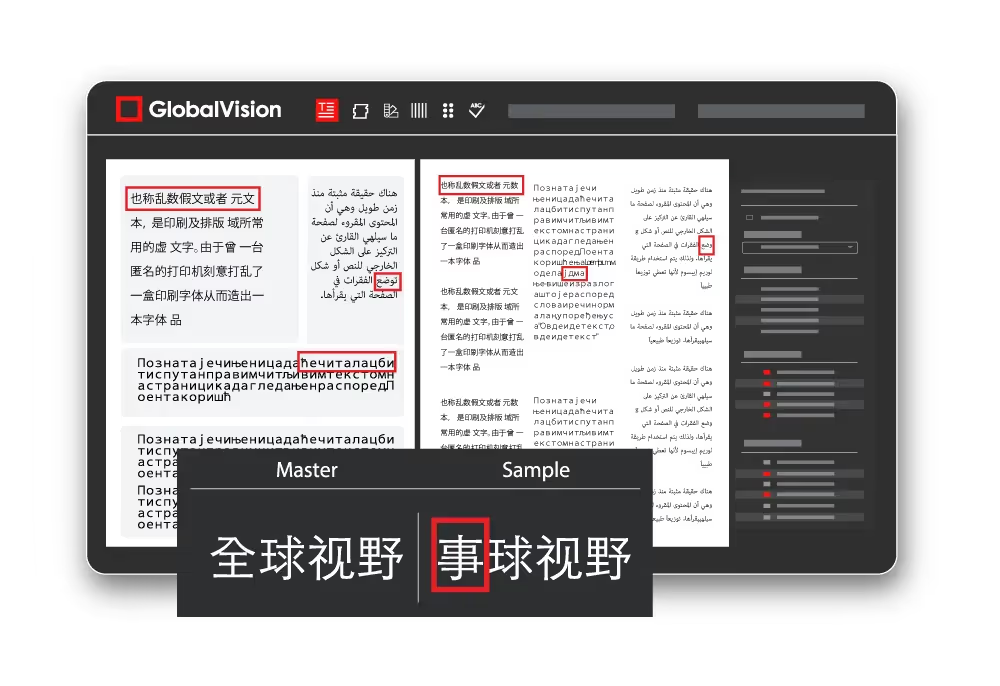
Dans l'industrie pharmaceutique, les directives de conformité et d'intégrité des données sont essentielles. Les données brutes doivent être conservées en cas d'enquêtes. Les outils de contrôle qualité numériques utilisent des pistes d'audit pour suivre toutes les activités, garantissant ainsi la conformité avec des organismes tels que les certifications ISO, le 21 CFR Part 11 et l'annexe 11. Les pistes d'audit sont importantes car elles sont essentielles au maintien de l'intégrité des données en suivant toutes les activités, y compris les inspections et les rapports. Des rapports d'inspection complets contribuent à protéger l'intégrité des données en fournissant une traçabilité complète indiquant qui a inspecté un produit et quels en ont été les résultats. Ces rapports permettent de suivre et d'examiner toutes les différences constatées entre les fichiers, afin de s'assurer que les modifications appropriées sont apportées.
Conclusion
Il ne fait aucun doute que les solutions numériques constituent une assurance contre les erreurs potentiellement catastrophiques, telles que l'absence de décimales dans les valeurs posologiques. La valeur qu'elles apportent aux sociétés pharmaceutiques va bien au-delà de l'élimination de la relecture manuelle. La nature des normes réglementaires continue d'évoluer, tout comme la nécessité de mettre en œuvre efficacement des solutions technologiques telles que le contrôle qualité automatisé. Ces innovations technologiques améliorent non seulement les processus entre les équipes, mais elles renforcent également la collaboration interfonctionnelle et fournissent aux sociétés pharmaceutiques les outils dont elles ont besoin pour être en mesure d'opérer à l'échelle mondiale.


