Was ist strukturierte Produktkennzeichnung (SPL)?
Structured Product Labeling (SPL) ist ein XML-basierter Dokumenten-Markup-Standard, der von Gesundheitsstufe Sieben (HL7), eine gemeinnützige Organisation, die Standards für den Austausch, die Integration, den Austausch und den Abruf von elektronischen Gesundheitsinformationen entwickelt.
SPLs werden von der benötigt FDA für die Einreichung von Kennzeichnungsinformationen für verschreibungspflichtige Humanarzneimittel, rezeptfreie Produkte (OTC), Biologika und mehr.
Das SPL-XML-Format strukturiert den Inhalt der Arzneimittelkennzeichnung auf maschinenlesbare Weise und stellt sicher, dass jeder Abschnitt, wie Dosierung, Warnhinweise und Verabreichungsanweisungen, gekennzeichnet und sowohl für den menschlichen als auch für den elektronischen Gebrauch organisiert ist.
Die FDA verwendet SPL zur Verarbeitung, Validierung und Veröffentlichung von Kennzeichnungsinformationen in öffentlichen Datenbanken wie Tägliches Med.
Warum SPL wichtig ist: Konformität, Genauigkeit und Geschwindigkeit
Jedes Pharmaunternehmen, das Produkte in den USA vermarktet, muss die SPL-Einreichungsanforderungen der FDA erfüllen.
Dies ist nicht nur ein technisches Format. SPL wirkt sich auf alles aus Anforderungen an die Arzneimittelkennzeichnung und Marktzulassungen zur Kompatibilität mit digitaler Gesundheit.
Wenn Sie keine genaue, validierte SPL einreichen, kann dies zu folgenden Folgen führen:
- Verzögerungen bei der Produktzulassung
- Ablehnung oder Anträge auf Wiedervorlage durch die FDA
- Bußgelder oder Abmahnungen
- Bußgelder
- Die FDA ist gemäß dem Federal Food, Drug, and Cosmetic Act (FD&C Act) befugt, zivilrechtliche Geldstrafen zu verhängen. Bußgelder für SPL-spezifische Verstöße werden zwar nicht immer veröffentlicht, aber die Nichteinhaltung der Kennzeichnungsvorschriften hat in einigen Fällen zu Strafen von über 100.000 USD geführt.
- Die FDA ist gemäß dem Federal Food, Drug, and Cosmetic Act (FD&C Act) befugt, zivilrechtliche Geldstrafen zu verhängen. Bußgelder für SPL-spezifische Verstöße werden zwar nicht immer veröffentlicht, aber die Nichteinhaltung der Kennzeichnungsvorschriften hat in einigen Fällen zu Strafen von über 100.000 USD geführt.
- Warnbriefe
- Zwischen 2021 und 2024 erhielten mehrere Unternehmen Warnschreiben der FDA, weil sie keine genauen oder zeitnahen SPL-Dateien eingereicht hatten, insbesondere in falsch markierte Medikamente und unvollständige Kennzeichnung. In diesen Schreiben werden häufig Verstöße gegen 21 CFR Part 201 angeführt und öffentliche Hinweise veröffentlicht, die das Vertrauen der Marke schädigen können.
- Risiko für die Patientensicherheit aufgrund ungenauer oder veralteter Informationen
Auf der anderen Seite stellt das Nagel Ihrer SPL-Einreichungen sicher:
- Schnellere Genehmigungen
- Weniger manuelle Korrekturen oder Validierungsfehler
- Nahtlose Aktualisierungen der elektronischen Arzneimittelkennzeichnungssysteme und -plattformen
Grundlegendes zu SPL-Datenelementen
Eine SPL-Datei ist mehr als nur ein digitales Dokument. Es enthält strukturierte Metadaten und Abschnitte, die den Zugriff auf und die Aufschlüsselung von Arzneimittelinformationen erleichtern.
Zu den wichtigsten SPL-Datenelementen gehören:
- Produkt- und Herstellerkennungen (z. B. NDC-Code, Firmenname)
- Versionsverlauf kennzeichnen
- Indikationen und Verwendung
- Dosierung und Verabreichung
- Gegenanzeigen und Warnhinweise
- Arzneimittelwechselwirkungen
- Informationen zur Verpackung
- Marktstatus und regulatorische Informationen
Jedes Element ist auf standardisierte Weise gekennzeichnet, sodass die FDA und Systeme von Drittanbietern den Inhalt automatisch lesen und validieren können.
SPL XML-Dateiformat
SPLs (Structured Product Labeling) müssen gemäß den strengen FDA-Anforderungen im XML-Format vorliegen.
Warum XML?
Die FDA schreibt vor, dass SPLs im HL7-kompatiblen XML-Format vorliegen, weil:
- XML ist maschinenlesbar und ermöglicht eine automatisierte Verarbeitung und Validierung.
- Es unterstützt die semantische Kennzeichnung von Arzneimittelinformationen (z. B. Dosierung, Inhaltsstoffe, Warnhinweise).
- Es gewährleistet die Interoperabilität zwischen verschiedenen Regulierungssystemen und Datenbanken.
Es ermöglicht eine strukturierte und standardisierte Einreichung, was für die Kennzeichnung, Zulassung und Aktualisierung von entscheidender Bedeutung ist.
Was muss in der XML sein?
Das SPL-XML muss:
- Entspricht dem HL7-SPL-Schema.
- Verwenden Sie Logical Observation Identifiers Names and Codes (LOINC), um Labelabschnitte zu definieren.
- Bestehen Sie die Validierung mit den SPL-Schema- und Stylesheet-Tools der FDA.
- Sie müssen über das Electronic Submissions Gateway (ESG) eingereicht werden.
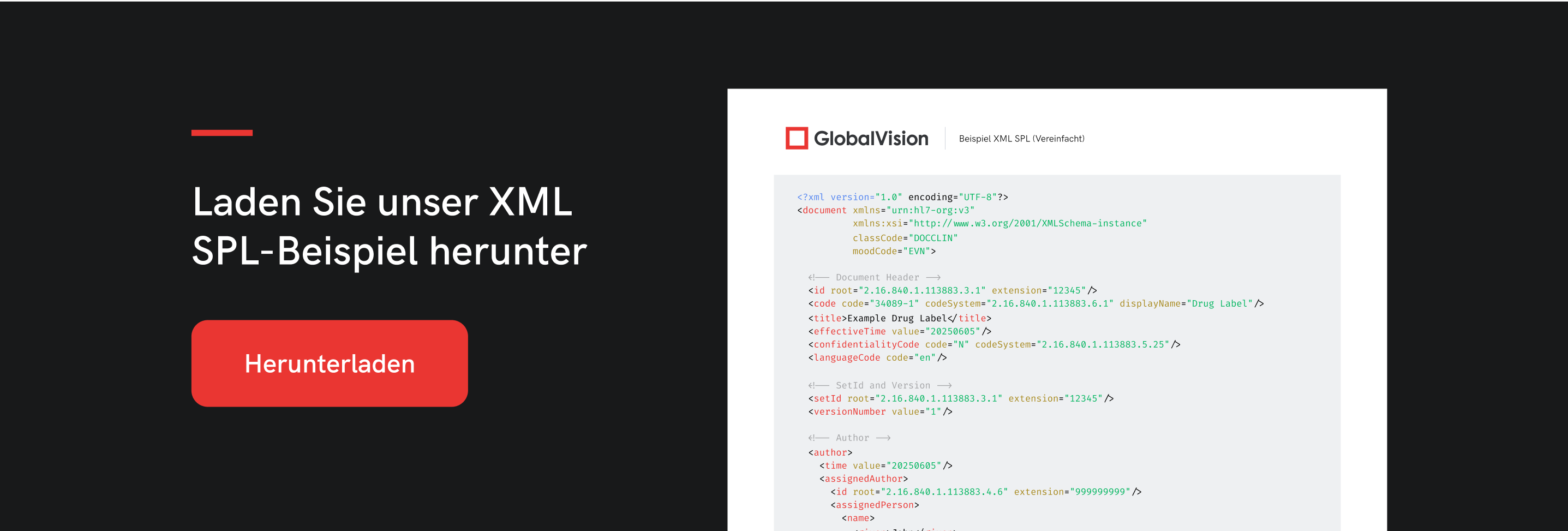
Wenn Sie gerade erst mit SPLs beginnen, laden Sie unser vereinfachtes Beispiel für ein SPL-XML-Dateiformat (Structured Product Labeling) herunter. SPL basiert auf dem HL7 Reference Information Model (RIM) und wird von der FDA zum Austausch von Informationen über Arzneimittelkennzeichnungen verwendet.
Bitte beachten Sie, dass dieses Beispiel nur eine grundlegende Struktur ist, die Ihnen das Verständnis des Formats erleichtern soll. Die von Seal SPL bei der FDA eingereichten Anträge sind deutlich detaillierter und müssen strengen Validierungsregeln entsprechen.
SPL für rezeptfreie (OTC) Medikamente und nicht verschreibungspflichtige Produkte
Viele Teams gehen fälschlicherweise davon aus, dass SPL nur für verschreibungspflichtige Produkte bestimmt ist.
Tatsächlich ist SPL für rezeptfreie Medikamente auch erforderlich, wenn das Produkt bei der FDA gelistet ist. Dazu gehören unter anderem Vitamine, Nahrungsergänzungsmittel und topische Mittel.
Die Einreichungsanforderungen und die Inhaltsstruktur sind ähnlich, obwohl für OTC-Produkte möglicherweise einfachere Kennzeichnungsanforderungen gelten. Dennoch müssen die Teams dieselben Standards einhalten, was bedeutet, dass das Verständnis der SPL auch außerhalb der Rx-Produkte unerlässlich ist.
FDA-SPL-Einreichungsanforderungen: Was Sie wissen müssen
Bevor Sie Ihre SPL-Dateien an die FDA senden, müssen Sie sicherstellen, dass Sie bestimmte Richtlinien befolgen. Einige von ihnen beinhalten:
- Richtiges SPL-XML-Format gemäß dem Leitfaden zur strukturierten Produktkennzeichnung der FDA
- Ein gültiges FDA ESG (Electronic Submissions Gateway) -Konto für die Übertragung
- Verwendung der korrekten Validierungsregelsätze, die von der FDA für Ihre Produktkategorie bereitgestellt werden
- Aufnahme aller Pflichtdatenfelder und Metadaten
Darüber hinaus müssen die Einreichungen dem PLR-Format (Physician Labeling Rule) für verschreibungspflichtige Medikamente entsprechen, das die Reihenfolge und die Kennzeichnungsanforderungen für bestimmte Abschnitte ändert.
Laden Sie unsere Checkliste herunter, um eine vollständige Checkliste der Einreichungsanforderungen zu erhalten, die Sie befolgen müssen.
Automatisierung der SPL-Generierung: Warum manuelle Methoden nicht mehr ausreichen
Angesichts der Komplexität von SPL-Dateien und des großen Risikos menschlicher Fehler setzen viele Teams auf automatische SPL-Generierung und SPL-Compliance-Software, um den Prozess zu rationalisieren.
Zu den Vorteilen der Automatisierung Ihres SPL-Workflows gehören:
- Reduziertes Risiko von XML-Formatierungs- oder Validierungsfehlern
- Versionskontrolle auf mehreren Produktetiketten
- Schnellere Updates wenn sich Vorschriften oder Produktdetails ändern
- Integration mit Systemen für regulatorisches Informationsmanagement (RIM)
Einige Tools bieten sogar eine integrierte Validierung, die Einreichung über das FDA-Gateway und die Nachverfolgung von Änderungen, was die Verwaltung von Kennzeichnungsaktualisierungen in Ihrem gesamten globalen Portfolio vereinfacht.
Die Rolle der strukturierten Produktkennzeichnung in der Zukunft der Pharmaindustrie
Der Trend zur elektronischen Arzneimittelkennzeichnung und zur Dateninteroperabilität zwischen Gesundheitsplattformen macht SPL wichtiger denn je. Da Initiativen wie IDMP (Identification of Medicinal Products) und globale UDI-Standards (Unique Device Identification) an Bedeutung gewinnen, wird eine strukturierte, digitale Kennzeichnung zur Norm werden.
Pharmateams, die heute in SPL-Wissen und Infrastruktur investieren, werden besser positioniert sein, um:
- Produkte in mehreren Märkten schneller auf den Markt bringen
- Fallstricke bei der Einhaltung von Vorschriften vermeiden
- Unterstützen Sie digitale Gesundheitsintegrationen
- Ermöglichen Sie systemübergreifende Etikettierungsaktualisierungen in Echtzeit
Ihr nächster Schritt zu einer intelligenteren Etikettierung
Die Beherrschung der strukturierten Produktkennzeichnung ist nicht nur eine technische Anforderung, sondern auch eine strategische Fähigkeit und ein Wettbewerbsvorteil.
Wenn Ihr Team das SPL-XML-Format, die FDA-SPL-Einreichungsanforderungen und die für die Automatisierung verfügbaren Tools versteht, kann es Compliance-Risiken und behördlichen Verzögerungen immer einen Schritt voraus sein.
Ganz gleich, ob Sie Updates für ein beliebtes Medikament verwalten oder ein neues OTC-Produkt einreichen, SPL ist ein zentraler Bestandteil Ihrer Kennzeichnungs- und Markteinführungsstrategie. Und mit dem Aufkommen automatisierter SPL-Generierung und SPL-Compliance-Software ist es einfacher denn je, konform, effizient und wettbewerbsfähig zu bleiben.
Häufig gestellte Fragen